
Если вы не врач, то мы рекомендуем Вам ознакомиться с общей информацией о разрывах ахиллова сухожилия (щелкните мышкой, чтобы перейти к статье для пациентов).
Программу реабилитации после разрывов ахиллова сухожилия вы можете посмотреть здесь.
Узнать о причинах болей в пяточной области и в ахилловом сухожилии при тенопатии ахиллова сухожилия,деформации Хаглунда и при плантарном фасциите («пяточной шпоре») вы можете в отдельных статьях.
Глава 5. ЛЕЧЕНИЕ СВЕЖИХ РАЗРЫВОВ АХИЛЛОВА СУХОЖИЛИЯ
Современные представления о репаративной регенерации сухожильной ткани
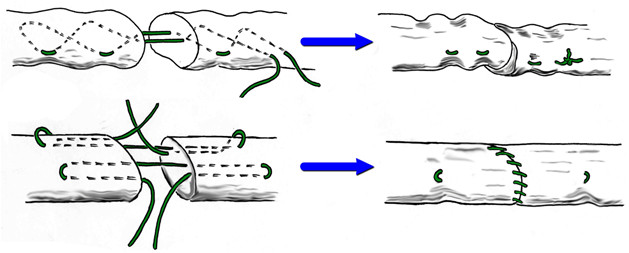
Обладает или нет сухожилие истинной регенераторной потенцией, остается спорным вопросом. Тем не менее, большинство исследователей отдают ведущую роль в процессе сращения сухожилия околосухожильным тканям. Основной принцип биологии репарации сухожилия может быть определен постулатом: «Одна рана — один рубец» [622]. Эта концепция базируется на экспериментальных наблюдениях, говорящих, что зрелые сухожильные клетки не способны синтезировать коллаген [259, 640, 641и др.]. Источником регенерации считают камбиальные элементы фибробластического ряда окружающей сухожилие соединительной ткани — эндотендиния, перитендиния, паратенона или стенок синовиального влагалища [1, 4, 14, 16, 39, 63, 92, 620 и др.]. С другой стороны, некоторые исследователи обнаруживали в поврежденных сухожилиях митотически делящиеся теноциты и на этом основании делали вывод о способности сухожильной ткани к пролиферации [3, 26, 35, 50, 504, 548]. Однако и они отводят главенствующую роль активности околосухожильных тканей. Так, многочисленные попытки совместить изоляцию сухожильных концов от окружающих тканей и сращение сухожилия оказывались безуспешными. Сращение либо не наступало, либо происходило за счет грануляционной ткани, врастающей снаружи под изолирующую муфту к сухожилию [14, 18, 259, 504, 622, 640, 642]. Напротив, даже при иссечении ахиллова сухожилия наблюдалось замещение дефекта и восстановление непрерывности сухожилия за счет рубцового регенерата, пролиферирующего из паратенона. Со временем регенерат становился почти неотличимым от самого сухожилия [265, 351, 495, 496, 679]. Имеется важная особенность процесса репарации сухожилия, окруженного паратеноном, а не синовиальным влагалищем. Так как синовиальное влагалище не двигается вместе с сухожилием, то образующиеся сращения между ними могут вызвать ухудшение или полное прекращение скольжения сухожилия. Если же влагалище образовано паратеноном, как у ахиллова сухожилия, то при сохранении его созревший регенерат сухожилия будет лучше скользить в этих эластичных тканях [8, 29].
Выделяют три основные фазы репаративной регенерации сухожильной ткани: экссудации и фибриноидного склеивания, фиброплазии и фазу созревания и дифференциации [544]. В период экссудации и фиброплазии (первые 2-3 недели) основными условиями, необходимыми для реваскуляризации области повреждения и фибриллогенеза, большинство исследователей считают сохранение околосухожильных тканей, функциональный покой и уменьшение натяжения в месте контакта сухожильных концов. При их соблюдении не повреждаются новообразованные сосуды паратенона, формирующие сосудистую сеть регенерата, уменьшается тенденция к образованию диастаза и предупреждается чрезмерная дезориентированная пролиферация грануляционной ткани [50, 125, 304, 434, 641]. Напротив, в фазу созревания и дифференциации полезным считается создание функциональной нагрузки в области репарации, в ответ на которую стимулируется клеточная активность и полимеризация фибрилл коллагена, которые ориентируются параллельно силам нагрузки. В конечном итоге физиологическое натяжение, мышечные сокращения и движения обеспечивают ремоделирование регенерата, повышение его прочности, растяжение спаек и улучшение условий скольжения сухожилия в его футляре [1, 35, 37, 39, 92, 104, 304, 334, 553, 622, 641]. Следует отметить, что окончательная перестройка поврежденного сухожилия происходит неопределенно долгое время. Так, динамику изменений в сшитом сухожилии обнаруживали даже через год после операции [99, 374].
Способы лечения свежих разрывов ахиллова сухожилия
Лечение пациентов с разрывами ахиллова сухожилия должно быть направлено на восстановление целостности ахиллова сухожилия и возврат пациента к физической активности на уровне, близком к таковому до травмы. Помимо этого, лечение должно минимизировать осложнения. Это может быть достигнуто как консервативным, так и оперативным способами [435, 583, 771]. В настоящее время нет четкого консенсуса в вопросе оптимальной тактики лечения разрыва ахиллова сухожилия. Установлено, что главным преимуществом оперативного лечения перед консервативным является снижение риска реруптуры, в то время как возрастает риск других осложнений [389, 435, 663, 771]. Хирургическое лечение может быть выполнено открытым, чрескожным и эндоскопическим способами, после чего применяются различные способы иммобилизации (лонгеты, функциональные брейсы) [663, 771]. Категоричные рекомендации по выбору способа лечения отсутствуют, так что он определяется предпочтениями пациента и хирурга с учетом желаемых функциональных результатов [485].
Основным методом лечения подкожных разрывов пяточного сухожилия является оперативный. По нашему мнению, закрытое повреждение пяточного сухожилия не является показанием к экстренной операции, однако желательно раннее хирургическое вмешательство. Большинство наших больных были по разным причинам оперированы на протяжении 1—2 недели после госпитализации. Более поздние оперативные вмешательства давали худшие результаты, так как возникала стойкая ретракция икроножной мышцы, гипотрофия, фиксация ее рубцами, развитие необратимых функциональных нарушений нервно-мышечного аппарата, выражавшееся в нарушении возбудимости тонуса и биоэлектрической активности мышцы. Задачи оперативного лечения: восстановление непрерывности сухожилия, создание нормального физиологического натяжения икроножной мышцы, восстановление опороспособности передней части стопы.
Многие авторы отвергают оперативное лечение разрывов ахиллова сухожилия, обосновывая свою точку зрения высокой частотой его осложнений [332, 339, 477, 601, 722, 721]. Arner и Lindholm [157], подведя итоги лечения 86 пациентов с разрывами ахиллова сухожилия, зарегистрировали осложнения в 24% случаев, включая два случая тромбоза глубоких вен, один из которых привел к тромбоэмболии легочной артерии и к летальному исходу. В трех случаях имели поверхностные инфекции области хирургического вмешательства, в одиннадцати – некрозы краев раны и реруптура имела место в четырех случаях. В более поздних исследованиях частота осложнений была значительно меньшей. Soldatis и соавторы в результате лечения 23 пациентов сообщили о двух осложнениях, оба из которых были представлены замедленным заживлением операционной раны [714]. Больший успех, вероятно, был обусловлен накопленным опытом хирургических вмешательств, отточенной и усовершенствованной техникой. Тем не менее, наиболее часто и стабильно встречаются осложнения процесса заживления операционной раны, весьма характерные после продольного разреза по задней поверхности голени, где мягкие ткани отличаются небогатым кровоснабжением [352].
Консервативное лечение вполне допустимо даже у молодых людей, не имеющих спортивных запросов. Например, в проспективном рандомизированном исследовании, включившем 40 пациентов со свежими разрывами ахиллова сухожилия, было сформировано две группы. В одной из них применялось консервативное лечение путем иммобилизации передней лонгетой в эквинусном положении на восемь недель, а в другой иммобилизацию лонгетой выполняли в течение трех недель, а затем применяли раннюю контролируемую мобилизацию при помощи шины Sheffield. Этот ортез ограничивает плантарную флексию на уровне 15 градусов, но позволяет выполнять движения в суставах Шопара и Лисфранка. Пациенты во второй группе значительно быстрее восстанавливали амплитуду движений в голеностопном суставе и раньше достигали нормального для них уровня повседневной активности. Сила плантарной флексии в результате лечения была одинаковой в группах, и не было отмечено ни одного случая элонгации ахиллова сухожилия. Повторный разрыв авторы наблюдали по одному случаю в каждой группе [677].
Существует достаточно много приверженцев консервативного лечения, однако в течение последних трех десятилетий наиболее часто применяется оперативное лечение, особенно у молодых пациентов и у спортсменов, а также в тех случаях, когда после травмы прошло несколько суток и пациент не получал никакого лечения.
Споры о том, какой способ лечения наилучший, будут, по всей видимости, бесконечны, так как вряд ли стоит ожидать консенсуса между хирургами, получающими большую [213, 338, 395] и малую частоту осложнений [250, 342, 381] и редкие реруптуры [202, 286, 388].
Хирургический доступ
Наиболее целесообразно положение пациента лежа на животе или полубоком с подложенной сбоку от туловища подушкой. При этом стопы пациента должны свисать с края операционного стола. К столу монтируют подставку, на которую в ходе операции можно положить стопу пациента так чтобы придать ей эквинусное положение. С этой целью может использоваться столик операционной сестры. Обрабатывают стопу и всю голень.
Хирургический доступ для открытого шва ахиллова сухожилия должен учитывать следующие особенности:
- Поверхностнее икроножного апоневроза и ахиллова сухожилия проходит икроножный нерв (n.suralis), который косо пересекает эти образования и в средней и дистальной третях ахиллова сухожилия располагается латеральнее него.
- Оперативному лечению разрывов ахиллова сухожилия традиционно свойственна высокая частота инфекционных осложнений и краевых некрозов операционной раны, которые после заживления значительно увеличивают размеры рубца.
- В ходе доступа должен быть максимально сохранен паратенон, который ответственен не только за кровоснабжение сухожилия, но и образует скользящий аппарат.
- Грубые рубцы по задней поверхности в нижней трети голени причиняют не только эстетические неудобства, но и могут быть болезненными и затруднять ношение обуви.
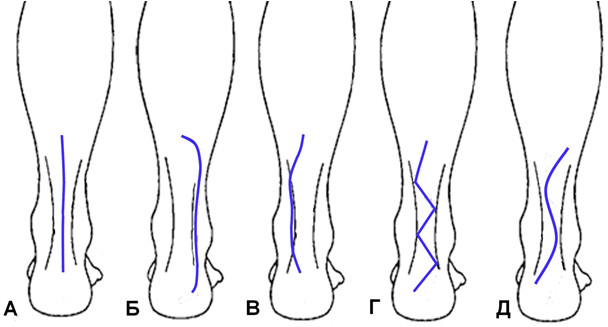
Менее всего этим требованиям отвечает продольный доступ по срединной линии (Рисунок 32). Продольные доступы обеспечивают хороший обзор сухожилия, но при их закрытии нередко возникает натяжение раны, могущее повлечь за собой развитие краевых некрозов. Отдельные авторы рекомендуют в таких случаях даже прибегать к профилактическим послабляющим разрезам [53, 82]. Более того, после продольного доступа с высокой вероятностью образуется гипертрофический кожный рубец, который постоянно травмируется при натяжении кожи (при тыльном сгибании стопы) и при давлении задника обуви. По этим причинам продольный доступ практически не упоминается в литературе, но, с другой стороны, он располагается на границе двух ангиосомов (кровоснабжаемых малоберцовой и задней большеберцовой артериями), и с этой точки зрения он, наоборот, благоприятен.
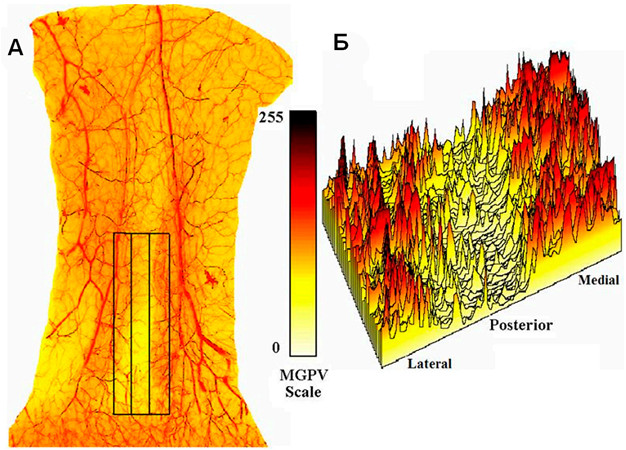
Ввиду этого особенный интерес представляют те работы, в которых исследуется кровоснабжение покровных тканей над ахилловым сухожилием, но, к сожалению, их оказалось не так много. Пожалуй, первая работа P.A. Haertsch и соавторов на эту тему вышла в 1981 году. В 1985 году Carriquiry и соавторы [243] описали анатомию перегородочно-кожных сосудов голени, а в 1987 году Taylor и Palmer [737] описали сосудистые территории (ангиосомы) с точки зрения пластической и реконструктивной хирургии. В 1997 году Whetzel и соавторы [791] изучали сосудистую сеть голени с инъекционных методик. Все эти исследования были качественными и не изучали плотность сосудистой сети в коже над ахилловым сухожилием.
Нам удалось обнаружить только одно количественное исследование плотности сосудистой сети: в 2010 году H. Yepes и соавторы опубликовали работу, в которой они изучали плотность сосудов спомощью специального программного обеспечения [812]. В результате они выделили три зоны: медиальную, латеральную и заднюю (Рисунок 31). Медиальная зона расположена между постеромедиальным краем ахиллова сухожилия и медиальной лодыжкой. Перфузия кожи в этой области характеризовалась относительным постоянством и обеспечивалась за счет 3-4 перфорантных артерий (диаметром от 0,9 до 1,1 мм). Кроме того, эти же перфорантные сосуды кровоснабжали и паратенон с медиальной стороны. Плотность сосудов в медиальной зоне равнялась 143±31 условным единицам.
Латеральная зона располагается от постеролатерального края ахиллова сухожилия и до заднего края латеральной лодыжки. Сосудистая сеть характеризовалась меньшим постоянством: в 70% случаев кровоснабжение осуществлялось за счет малоберцовой артерии, а в 30% — за счет возвратной ветви малоберцовой артерии. И в том, и в другом случае имелись 3-4 перфорантных артерии (0,8-0,9 мм в диаметре), которые, кроме того, кровоснабжали и паратенон. Плотность сосудистой сети составила 132±23 условных единицы.
Задняя зона располагается непосредственно над ахилловым сухожилием и характеризуется наименьшей плотностью сосудов (103±19 условных единиц). Кровоснабжение в этой зоне осуществляется за счет перфорантных сосудов и за счет артериол, анастомозирующих с сосудистой сетью медиальной и латеральной зон.
Авторы делают вывод о том, что с точки зрения плотности сосудистой сети доступы через заднюю зону нежелательны. Но с другой стороны, как мы уже отмечали, именно такой доступ будет располагаться между двумя ангиосомами. Соответственно, этот теоретический конфликт целесообразно разрешить клиническими исследованиями, но, к сожалению, нам не известны работы на эту тему с качественным дизайном.
Остальные доступы можно условно разделить на на околосухожильные, фигурные и миниинвазивные. Околосухожильный доступ может быть линейным или изогнутым. Впервые его применил E. Abraham и A. Pankovich в 1975 году [136].
Ряд хирургов предпочитают разрезы по латеральному краю сухожилия на том основании, что кожа наружных отделов голени более подвижная [69, 71, 117, 290]. Другие, во избежание повреждения икроножного нерва, используют медиальный доступ [55, 88, 104, 157, 274]. Преимущества околосухожильного доступа заключаются в сохранении неповрежденной кожи непосредственно над сухожилием, относительно высокая косметичность рубца и сохранение кровоснабжения краев раны при экономной диссекции. В связи с тем, что кожные складки ориентированы поперечно ходу ахиллова сухожилия, возможен и зигзагообразный доступ [6, 93, 94, 388].
На высокую частоту проблем с заживлением послеоперационной раны указывали еще в 1955 году Lawrence, Cave и O’Connor, подытожившие результаты лечения пациентов с разрывами ахиллова сухожилия, проходивших лечение в Massachusetts General Hospital с 1900 по 1954 год [475]. По данным разных авторов, частота краевых некрозов послеоперационной раны варьирует от 3 до 35 и более процентов. Кожа над ахилловым сухожилием располагается на границе двух сосудистых бассейнов – задней большеберцовой и малоберцовой артерий, и ее перфузия по сравнению с другими участками тела невелика [352]. Кроме того, на уровне лодыжек мягкие ткани малоподвижны и их объем невелик, возникающий послеоперационный отёк достаточно легко компрометирует и без того невысокую перфузию кожи. В ходе доступа к ахиллову сухожилию рассекается глубокая фасция голени, которая выполняет функцию retinaculum сухожилия, формируя его изгиб в дистальной части. В результате этого, после операции изгиб сухожилия кпереди уменьшается, что приводит к дополнительному давлению на послеоперационную рану.
Волне логично, что эту проблему хирурги пытались разрешить, совершенствуя хирургический доступ и используя иные хирургические пособия. Например, A. Mohammed и соавторы использовали мягкотканую префабрикацию, которая выполнялась при помощи экспандера в течение 8-10 недель у четверых пациентов с высоким риском некроза послеоперационной раны [569].
Aldam С.Н. (1989) использовал поперечный разрез при лечении 41 пациента с разрывами ахиллова сухожилия, который оказывался достаточным для выполнения блокирующего шва Bunnell (Рисунок 33). Осложнения процесса заживления операционной раны автор наблюдал только в одном случае. [144]. К сожалению, в своей работе Aldam не уточнил средний срок, который прошел с момента разрыва сухожилия до операции. Случаи несвежих разрывов ахиллова сухожилия, вероятно, будут ограничивать использование предложенной им методики.
Для уменьшения риска некроза послеоперационной раны еще в 1973 году было предложено использовать Z-образную пластику [343, 646], а S.M. Green и P.J. Briggs в 2002 году предложили использовать для оперативного лечения разрывов ахиллова сухожилия прямую и обратную Z-пластику (Рисунок 34) [348]. К сожалению, малое число пациентов, вошедших в эти исследования, не позволяет оценить эффективность Z-пластики. В любом случае, если предпринято решение использовать Z-пластику, следует руководствоваться общими принципами пластического закрытия ран, которые подразумевают полнослойное формирование лоскутов с сохранением субдермальной сосудистой сети, а вершина лоскута должна иметь угол в 60 градусов [666].
J.S. Chana и соавторы предложили использовать оригинальный П-образный доступ, благодаря которому сразу формируется несвободный мягкотканый лоскут на дистальном основании. Вертикальные границы лоскута располагаются чуть позади обеих лодыжек, а верхняя граница проходит над икроножным апоневрозом. Таким образом, стороны лоскута соотносятся как 3:1. После операции лоскут подшивается к нативному месту, а если доступ применяется по поводу операций, направленных на удлинение ахиллова сухожилия, то после ушивания раны по верхней границе лоскута образуется дефект, который закрывают полнослойным или расщепленным кожным лоскутом (Рисунок 35). Авторы применяли такой доступ в трех случаях, один из которых – свежий разрыв ахиллова сухожилия, второй – застарелый, а в третьем случае доступ использовался для удлинения ахиллова сухожилия [255].
A. P. Rumian и соавторы предложили использовать латеральный доступ, который они применили у 71 пациента со свежими разрывами ахиллова сухожилия. В 92% случаев операция выполнялась под жгутом, что облегчало идентификацию икроножного нерва, после чего выполнялось сшивание разорванного сухожилия по Kessler. По их данным, частота краевых некрозов раны составила 1,4%, в 2,8% авторы наблюдали рефлекторную симпатическую дистрофию (разрешилась спонтанно в течение 6-10 месяцев), и в 1,4% случаев они наблюдали нейропатию икроножного нерва (Рисунок 36) [673].

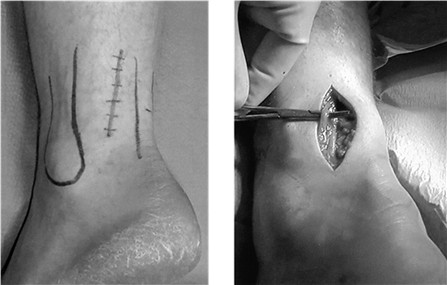
M.R. Carmont и N. Maffulli предложили использовать двухдоступную методику реконструкции ахиллова сухожилия, преимуществами которой является сохранение интактной кожи над местом разрыва ахиллова сухожилия, что должно благотворно влиять на сохранение кровоснабжения в этом месте (Рисунок 37) [241]. Авторы применяли предложенный способ только для лечения пациентов с застарелыми разрывами, однако мы считаем, что он может быть полезен и при оперативном лечении пациентов со свежими разрывами.
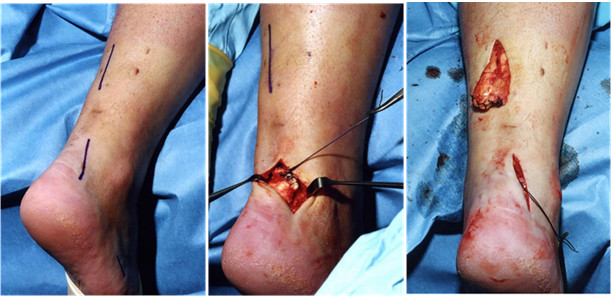
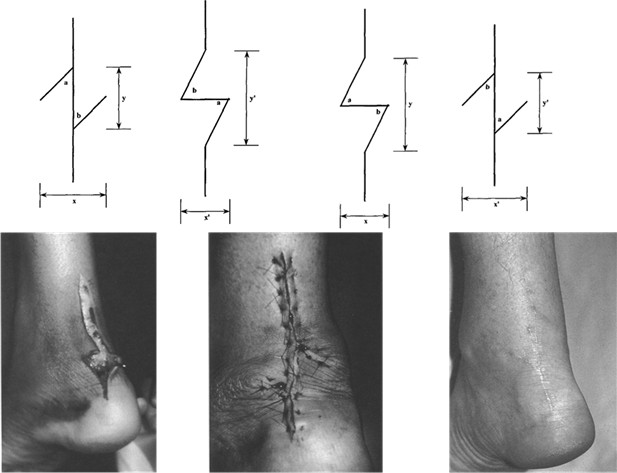
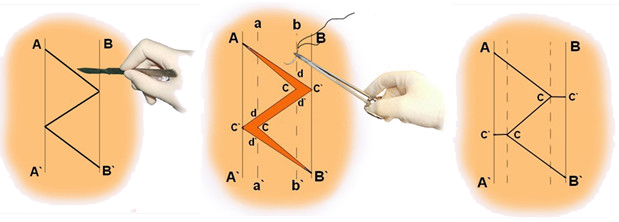
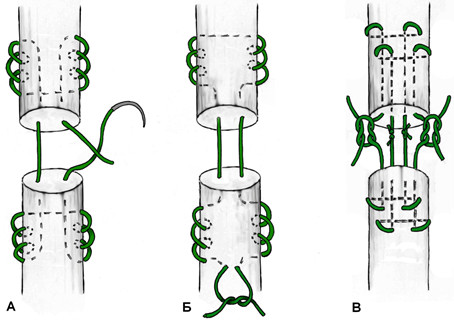
Мы считаем целесообразным использовать Z- образный разрез по задней поверхности голени в проекции разрыва ахиллова сухожилия (Рисунок 38), который ушивают следующим образом: края раны, находящиеся на линиях aa` и bb`, сшивают между собой (точки d, d`, c), при этом не восстанавливают исходное положение точек c и с`. Благодаря появлению отрезка сс` ослабевает натяжение раны в горизонтальном направлении, что положительно сказывается на перфузии кожи и, соответственно, на заживлении, и снижает вероятность краевого некроза.
Предложенный нами Z-образный доступ был применен у 34(36,2%) пациентов со свежими и застарелыми разрывами ахиллова сухожилия (Рисунок 39), а его эффективность сравнивали с результатами использования линейного парасухожильного доступа у 60(63,8%) пациентов. После операции изучали такие параметры, как частоту и площадь краевых некрозов, нарушение чувствительности в зоне иннервации икроножного нерва, частоту лигатурных свищей, спаянность рубца с подлежащими тканями и удовлетворенность пациента внешним видом рубца . Так как площадь некроза раны является динамической величиной и может как увеличиваться, так и уменьшаться, то для сравнения мы брали максимальную зарегистрированную площадь.
В послеоперационном периоде краевые некрозы операционной раны возникли только у 2(5,9%) пациентов с Z-образным доступом. У одного пациента дефект мягких тканей возник при падении на костылях после поскальзывания (с расхождением неокрепшего послеоперационного рубца в результате падения). У этого пациента площадь краевого некроза (дефекта мягких тканей) составила 1 см2. Так как у этого пациента имелась реруптура, то было предпринято оперативное лечение, в ходе которого и был скорректирован диастаз краев раны. У второго пациента из группы с Z-образным доступом (Рисунок 40) краевой некроз площадью 0,5 см2 был успешно разрешен с помощью консервативных мероприятий.
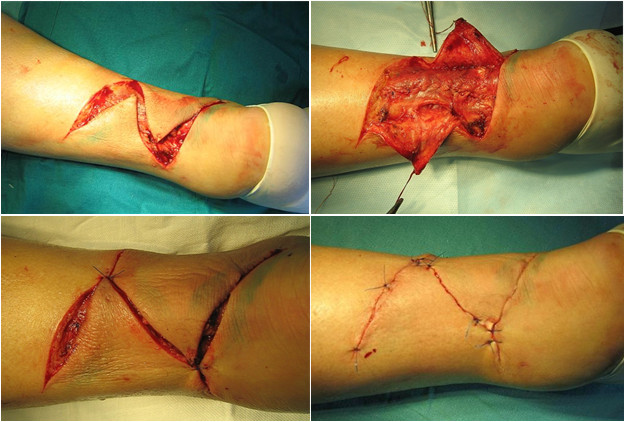
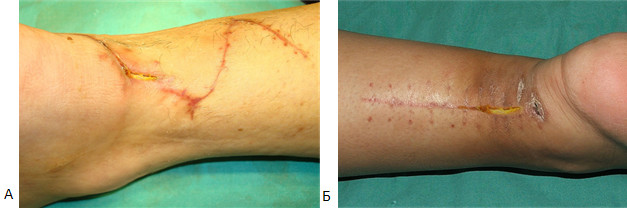
В группе пациентов с прямыми доступами краевые некрозы послеоперационной раны развились у 19(31,7%) больных (Рисунок 40) и их средняя площадь равнялась 1,6±0,2 см2. Во всех случаях краевые некрозы локализовались у нижнего полюса раны. У 17(28,3%) пациентов из группы с прямым доступом краевой некроз эпителизировался в результате консервативных мероприятий, а у 2(3,3%) пациентов потребовались хирургические вмешательства. У одного из них была выполнена хирургическая обработка с дерматотензией, а второму была выполнена несвободная пластика островковым лоскутом на сосудистой ножке.
Площадь некрозов была достоверно меньшей среди пациентов с Z-образным доступом (p=0,0044), частота некрозов при непараметрическом анализе была также достоверно меньшей (Таблица 4).

Неврологические нарушения, обусловленные повреждением икроножного нерва, имели место у 1(2,9%) пациента из группы с Z-образным доступом и у 2(3,3%) пациентов из группы с прямым доступом. По частоте этих осложнений группы не различались между собой, а функция нерва во всех случаях восстановилась полностью и самостоятельно без выполнения дополнительных хирургических вмешательств, фармакологической и физиотерапевтической коррекции.
Лигатурные свищи на различных этапах наблюдения нам встретились только у 2(3,3%) пациентов из группы с прямым доступом. Такая низкая частота этих осложнений, на наш взгляд, была обусловлена тем, что для сшивания паратенона мы использовали рассасывающийся шовный материал. Спаянность послеоперационного рубца с подлежащими тканями также оказалась меньшей при использовании Z-образного доступа (Таблица 5), и удовлетворенность пациентов внешним видом рубца была большей в группе Z-образного доступа (Таблица 6).
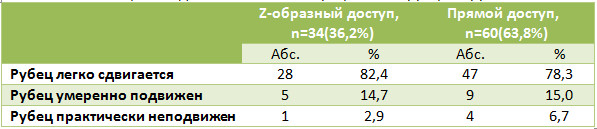
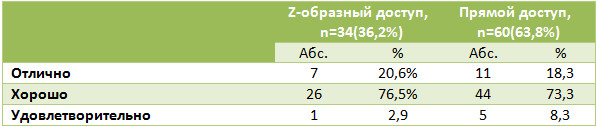
Таким образом, Z-образный доступ позволил достоверно снизить как частоту, так и площадь краевых некрозов послеоперационной раны вне зависимости от того, был ли у пациента свежий или застарелый разрыв, но при этом доступ не влиял на спаянность послеоперационного рубца и на удовлетворенность пациентов.
Вне зависимости от того, какой доступ будет выбран, его размеры должны позволять выполнить планируемый шов ахиллова сухожилия. После рассечения кожи обнажается паратенон, который вскрывают вдоль хода сухожилия. При этом необходимо свести к минимуму диссекцию между паратеноном и подкожно-жировой клетчаткой, чтобы сохранить сосудистую сеть обеих структур. Если в ране визуализируется икроножный нерв, то его отводят в латеральном направлении. Целенаправленный поиск икроножного нерва нецелесообразен. После рассечения паратенона вскрывается гематома в месте разрыва, которая в зависимости от давности разрыва может находиться на различных стадиях соединительнотканного перерождения. В любом случае ее эвакуируют полностью. Далее обнажаются проксимальная и дистальная культи разорванного сухожилия, которые имбибированы кровью.
Для снижения риска краевого некроза раны разрабатывались и другие методики оперативного лечения разрывов ахиллова сухожилия, такие как чрескожный шов и эндоскопический шов, которые будут рассмотрены позже.
Виды сухожильных швов
После выделения культи сухожилия и эвакуации гематомы приступают к восстановлению целостности сухожилия. Чаще всего для соединения концов сухожилия накладывают сухожильный шов. Целью шва сухожилия является удержание разорванных концов сухожилия в контакте друг с другом до тех пор, пока формирующаяся в месте разрыва ткань сама не будет способной поддержать необходимую длину сухожилия. При этом значительное натяжение сухожилия при сшивании может привести в последующем (при выведении стопы в правильное положение) к несостоятельности сухожильных швов либо к сохранению эквинусного положения стопы.
К сожалению, шовные нити не только удерживают концы сухожилия в контакте, но и могут сдавливать внутрисухожильные сосуды, изменять внутритканевое давление, нарушать ориентацию регенерирующих волокон, вызывать продуктивное воспаление и усиливать образование спаек, а также служить источником развития инфекции [20, 38, 50, 56, 110, 130]. Ряд авторов считает, что через 3-4 недели сухожильный шов становится ненужным, т.к. концы сухожилия уже удерживаются молодой рубцовой тканью [15, 50, 99, 434, 544], а удаление нити из сухожилия в этот период будет только способствовать правильному распределению сил натяжения и, следовательно, ремоделированию рубца. Поэтому многие хирурги отдают предпочтение съемному проволочному шву Bunnell [121, 229, 696 и др.].
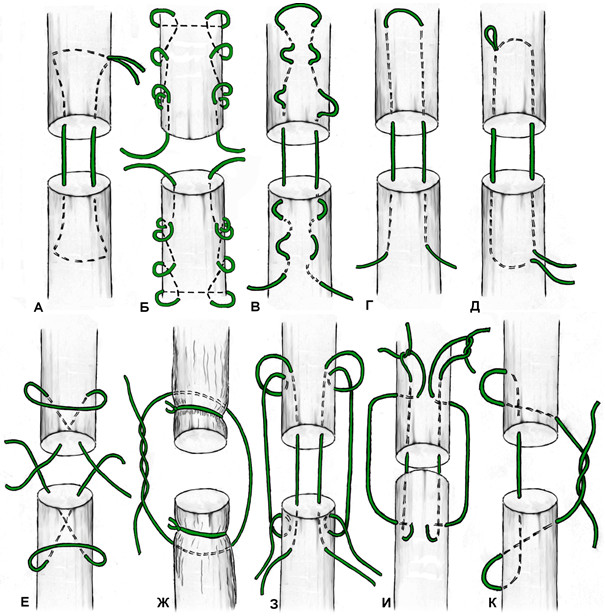
Всего известно около ста видов сухожильных швов, причем практически все они могут использоваться для сшивания ахиллова сухожилия. Принципиально сухожильные швы мы предлагаем классифицировать следующим образом:
По количеству нитей, пересекающих место разрыва: двух-, четырех-, шестижильные, парно жильные и т.д., с использованием блок-петель в месте разрываПо количеству узлов (количеству связываемых нитей), при завязывании которых сопоставляются разорванные концы сухожилия: одно-, двух-, трех-, четырехузловые.По месту расположения стягивающих узлов: вне места разрыва, в месте разрыва, комбинированныеПо расположению нитей (направлению векторов сил) относительно оси сухожилия: преимущественно параллельное (недеформирующие сухожильные волокна), крестообразное или косое прохождение нитей (деформирующее сухожильные волокна), с сопоставлением концов сухожилия не «конец-в-конец» (по Пульвертафту, спиральные швы).По преобладающему месту расположения нитей: на поверхности сухожилия (обвивные, матрацные, зигзагообразные), погружные, периферические (эпитендинозные), комбинированные.По расположению нитей на поперечном срезе сухожилия: одноплоскостные, многоплоскостные (располагающиеся в разных секторах поперечного среза)По методу фиксации: истинно сухожильные, с фиксацией к кости (чрескостный канал, якорный фиксатор), гарпунные.По варианту прошивания проксимальной и дистальной культи сухожилия: зеркальные (культи прошиваются одинаково), ассиметричные (культи прошиваются по-разному)По биомеханическому предназначению: несущие нагрузку (ствольные швы) и адаптирующие (эпитендинозные, разновидности шва Клейнерта)
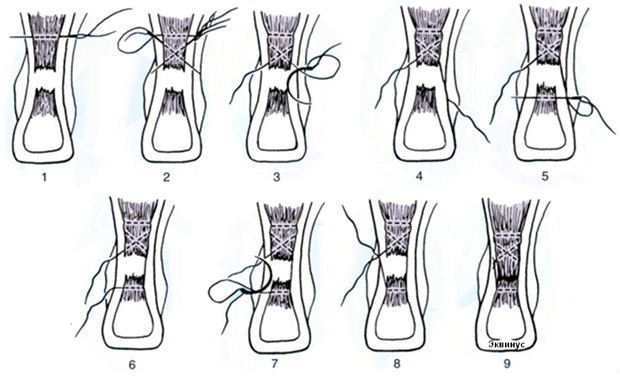
Однако, несмотря на многообразие предложенных сухожильных швов, на протяжении многих десятилетий широко использовались далеко не все из них. К наиболее распространенным можно отнести ставший классическим шов, предложенный французским хирургом В. Cuneo (1873-1944). При этом шве соединение концов сухожилия выполняется двумя внутриствольными зигзагообразными швами с выведением концов нитей в плоскости срезов сухожилия. Примечательно, что такое эпонимическое наименование встречается преимущественно в отечественной литературе [24, 36, 43, 53, 82, 94], а в иностранной такой шов называют именем английского хирурга Sterling Bunnell (1882-1957) [228, 230, 439] (Рисунок 41). В результате выполненного нами библиографического поиска мы не смогли обнаружить каких-либо печатных работ на тему сухожильного шва, принадлежащих перу В. Cuneo, а работа Sterling Bunnell, посвященная лечению повреждений сухожилий сгибателей кисти, была опубликована в журнале Surgery, Gynecology and Obstetrics в январе 1918 года [228]. Двойное эпонимическое именование шва «Slerling Bunnell-Cuneo’s lace suture» обнаружено нами лишь однажды [437]. Таким образом, этот сухожильный шов по всей видимости целесообразно называть именем Bunnell, или, учитывая отечественные традиции, можно применять и двойной эпонимический термин: Bunnell-Cuneo. В литературных источниках можно встретить различные модификации этого вида шва, отличающиеся количеством перекрестов в сухожилии (короткие и длинные варианты в зависимости от числа повторяющихся «мономеров»), местом завязывания узла (вне места разрыва, внутри места разрыва) и количеством узлов (один или два).
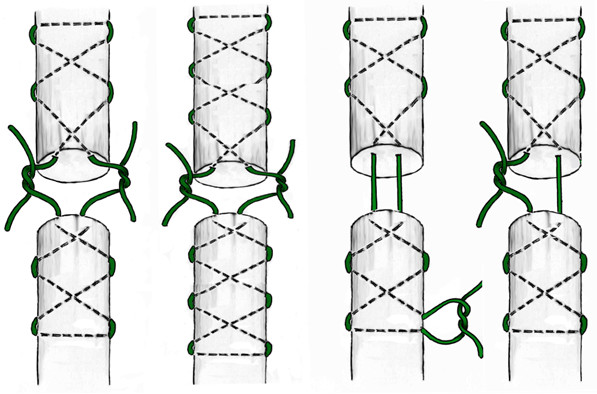
В течение многих десятилетий этот шов оставался наиболее популярным среди хирургов [44, 45, 46, 133]. Многие хирурги до сих пор используют в своей работе этот шов, в основном на кисти и предплечье [25, 32, 122]. Некоторые авторы для увеличения прочности шва Bunnell-Cuneo предлагали располагать его «мономеры» в разных плоскостях [133]. Однако шов Cuneo-Bunnell нельзя назвать простым и малотравматичным, так как он требует относительно большого числа вколов и выколов нити. Причем сделать это нужно на сравнительно небольшом отрезке, отступя от среза сухожилия 0,7-1 см [41], 1-1,5 см [47] или 2 см [77]. Существенными недостатками шва Bunnell-Cuneo являются сдавление сосудов и разволокнение ткани сухожилия [103].
Модификацией шва Bunnell-Cuneo, традиционно в отечественной литературе именуемой швом Bunnell, является шов с меньшим количеством перекрестов. Еще в 1936 году А.М. Дыхно предложил атравматичный сухожильный шов, при наложении которого каждый «новый» вкол иглы производится в место выкола [49]. Этот прием Е.Маннингер (1982) применял при использовании шва Bunnell [76]. Позднее в эксперименте было доказано, что чем большая часть шовного материала погружена в ткань сухожилия, тем прочнее шов [781]. Однако при использовании этого шва, по мнению многих авторов, нарушается кровообращение сухожилия за счет деформации при затягивании (Рисунок 42). Так, например, L.Milford писал, что шов Bunnell-Cuneo приводит к деваскуляризации концов сухожилия. Этот недостаток, отсутствующий у швов с параллельным расположением нитей и блокирующими петлями, стал причиной уменьшения популярности шва Bunnell-Cuneo [566]. Помимо нарушения кровоснабжения, деформация, возникающая при затягивании шва, служит причиной и переориентации хода сухожильных волокон, что неминуемо приведет к снижению биомеханических свойств сухожилия, в частности его эластичности.
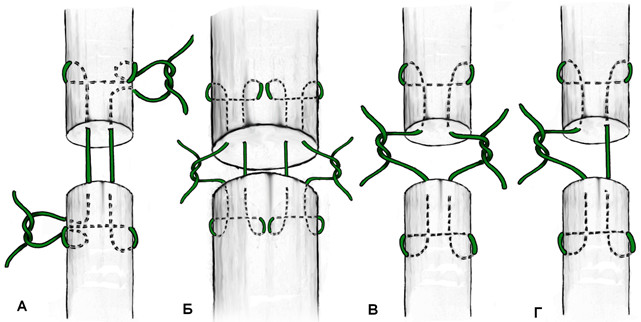
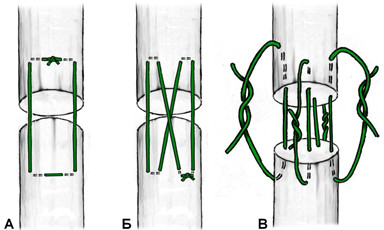
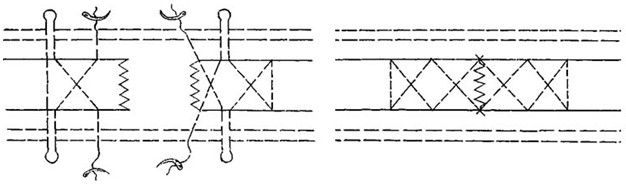
Другой группой сухожильных швов являются швы с прохождением нитей параллельно оси сухожилия и фиксацией внутри него с помощью петель. Сразу стоит оговорить, что петли по взаимоотношению продольного и поперечного компонентов нити могут быть двух видов: блокирующими и охватывающими (Рисунок 43). Считается, что блокирующие петли обеспечивают более надежную фиксацию нити в сухожилии, в то время как охватывающие способны протягиваться через сухожилие при приложении значительной нагрузки к нити. Положительным их качеством является меньшее количество шовного материала на поверхности сухожилия, что принципиально для интрасиновиальных швов.
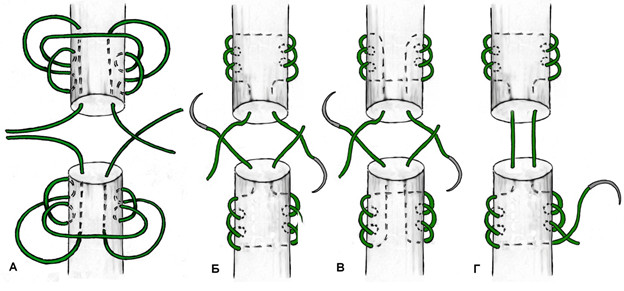
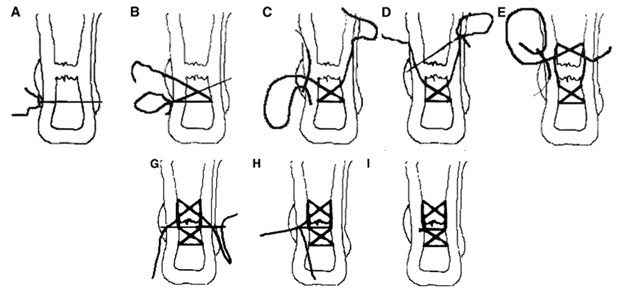
Другим распространенным представителем группы швов с расположением нитей параллельно сухожильным волокнам и с охватывающими петлями является шов по Kessler, который предложил свою методику сухожильного шва в 1973 году [433]. Позже этот шов в небольшой модификации стал очень популярным, но на самом деле эта модификация шва была предложена японским хирургом T. Tajima, который использовал такой шов в своей практике еще до 1963 года [302]. Но на самом деле шов Kessler-Tajima является разновидностью шва В.И. Розова, который описал этот шов в своей диссертации на соискание ученой степени доктора медицинских наук еще в 1951 году [101, цит. по 151, 252 и др.] (Рисунок 44).
Идея параллельного проведения нитей внутри сухожилия с фиксацией охватывающими петлями на поверхности сухожилия используется в шве Казакова, весьма популярном среди отечественных хирургов. Однако относительная сложность его выполнения и обилие шовного материала на поверхности сухожилия стали причинами его модификаций. Например, так появился шов Казакова-Розова, который по сути представляет собой шов Розова с еще одним ярусом охватывающих петель (Рисунок 45) [56, 57, 87, 89, 104, 106].
Все описанные варианты швов оставляют хирургу простор для их изменения и комбинирования. Так, возможно наложение шва Казакова-Розова как обратного, так и прямого, с различным количеством узлов и их положением. Например, накладывая двойной шов Розова-Kessler-Tajima, получаем шов Lee [480]. При выполнении прямого шва Казакова-Розова и завязывании узла на поверхности одного из концов сухожилия получаем шов по Фришу (Рисунок 46).
К наиболее «старым» сухожильным швам относится и шов с проведением нитей перпендикулярно оси сухожилия, предложенный M.L. Mason в 1940 году [542, 543] (Рисунок 47).
К швам с преобладающим расположением нитей на поверхности сухожилия можно отнести и эпитендинозные швы. Такие их разновидности как матрацный, восьмиобразный, шов Роттера (Рисунок 48) выполняются с помощью нескольких отдельных нитей с отдельными узлами, а другие могут быть выполнены с помощью одной нити, огибающей сухожилие по всей его окружности (Рисунок 49). Все эти разновидности для сшивания ахиллова сухожилия самостоятельно не используются, а могут быть наложены только как дополнительные адаптирующие швы.
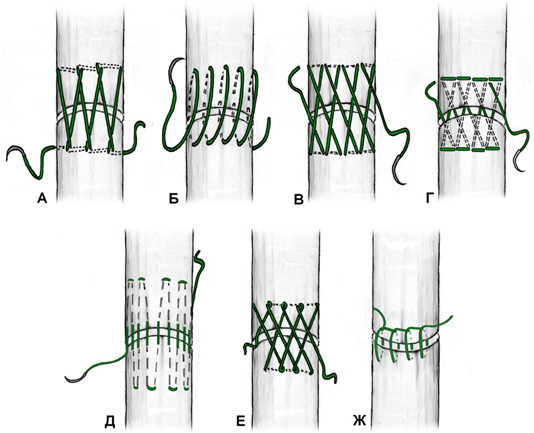
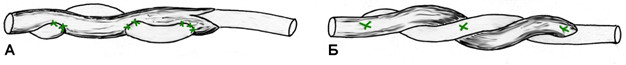
Из числа швов с преимущественным расположением нитей на поверхности сухожилия можно выделить группу обвивных швов и швы типа Becker [187]. В иностранной литературе классический обвивной шов называют швом Krackow, который был предложен K.A. Krackow в 1986 году (Рисунок 50). Прохождение нити при наложении шва по Krackow напоминает таковое в шве Казакова-Розова. Однако принципиальным отличием шва Krackow являются блокирующие петли, в отличие от захватывающих петель шва Казакова-Розова. Также, преимущественно наружное расположение нити ухудшает скользящие свойства восстановленного сухожилия, что делает этот шов малопригодным для интрасиновиального сухожильного шва, но абсолютно не мешает его применению при разрывах ахиллова сухожилия, сухожилия четырехглавой мышцы бедра, вращательной манжеты плеча. Шов Krackow может быть выполнен одной нитью или представлять собой два шва, расположенных один выше, вокруг или поверх другого под определенным углом. Также может отличаться количество ярусов («мономеров») петель – от 2 и больше (Рисунок 51). [456].
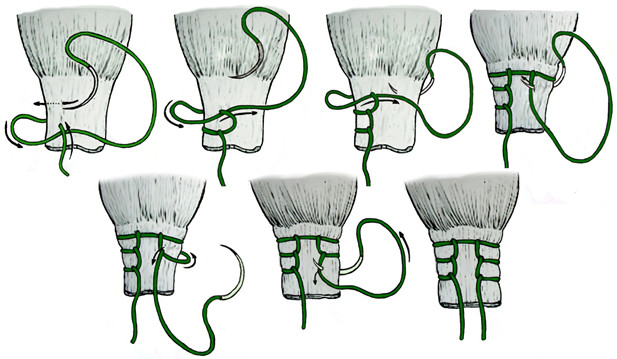
Стежковый сухожильный шов был предложен Becker в 1977 году для сшивания косых разрывов сухожилий [187]. Позже шов Becker был модифицирован и использовался для сшивания поперечных разрывов сухожилий, при этом используется две или три раздельных нити [233] (Рисунок 52).
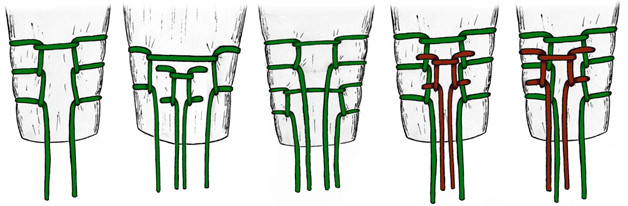
Как видно, швы по Becker могут иметь две, четыре или шесть нитей, проходящих через плоскость разрыва сухожилия. Идея использования перекрестных стежков используется в шестижильных швах по Savage [680], количество которых уменьшается у Sandow [678] и приходит к нулю, превращаясь в стежки матрасного шва, у Lim [492]. Все эти швы можно характеризовать как непрерывные шестижильные швы (CSSS, англ. «continuous six strand suture», Рисунок 53).
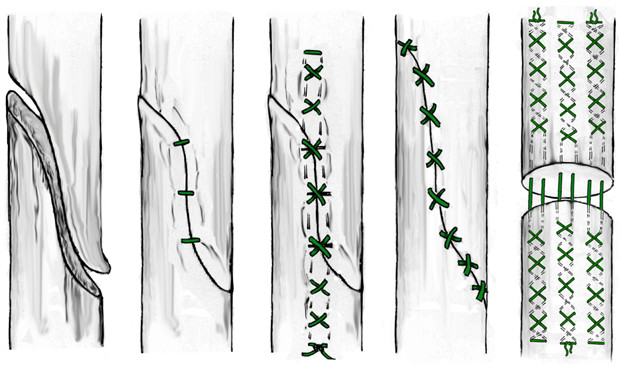
Из четырехжильных швов в литературе чаще встречаются описания шва по Strickland [727], известного также как индианский шов или шов Indiana по названию клиники, в которой он был разработан (Indiana Hand Center). Этот шов является, по сути, комбинацией шва Розова-Kessler-Tajima и матрацного шва, известного также как шов Ланге. Также к четрыхжильным швам относятся швы Lee [480, 481], Winters-Gebberman, Robertson (иногда его еще называют швом по Robertson-al-Qattan) [664], Silva [706]. Каждый из этих швов может быть выполнен парной нитью (Рисунок 54). Преимуществом многожильных швов (включая швы с одной или двумя нитями по Krackow [456]) является то, что они позволяют более равномерно распределить нагрузку в поперечном сечении сухожилия за счет секторального расположения нитей (т.е. каждая из нитей располагается в разных секторах). Принцип биомеханического распределения векторов сил особенно важен для самого крупного сухожилия – ахиллова. Наиболее интересный шов, учитывающий пространственное распределение векторов сил, на наш взгляд предложен A.P. Moores и соавторами в 2004 году [575].Особенно интересен тот факт, что этот шов воспроизводит биомеханическую модель спирального хода волокон (Рисунок 55). Пока этот шов использовался только в ветеринарии [177, 574].
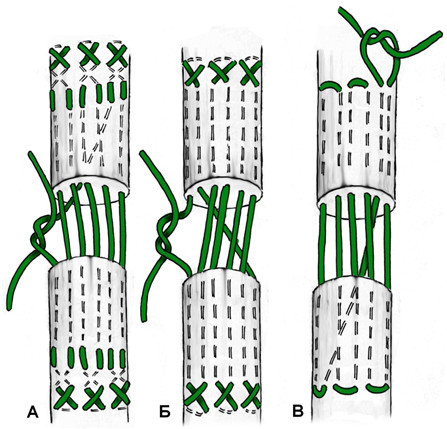
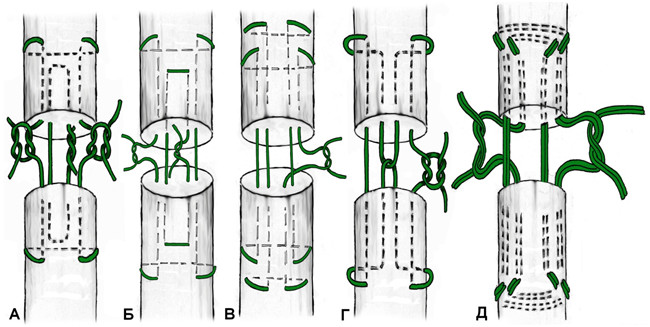
В 1975 году японский хирург Kenya Tsuge предложил свою технику наложения сухожильного петлевого шва, расположенного полностью в аваскулярной зоне сухожилия[766] . Отличительной особенностью этого шва являлась фиксация к сухожилию сдвоенной петлей. Однако изначальная техника наложения шва была достаточно сложной. В 1977 и 1985 году были предложены авторские модификации шва. Последний вариант приобрел достаточную популярность среди хирургов благодаря своей простоте и атравматичности. Недостатками этого варианта петлевого шва является менее прочная фиксация одного из концов сухожилия и расположение узла на поверхности сухожилия.
Известен шов Tsuge в модификации С.Eaton [298], добавившего еще один вкол и выкол иглы, что повысило прочность шва. Этот способ фиксации нити известен как «реверсивный» шов Kessler, так как при его выполнении те участки нити, которые погружены в толщу сухожилия в шве Kessler, находятся на поверхности сухожилия.
N.Labana с соавторами [467] в 2001 году предложили модификацию шва Tsuge, которая отличается от исходной большим количеством нитей, проходящих в толще сухожилий. По сути, это 2 или 3 наложенных на сухожилие оригинальных шва Tsuge. Это модификация известна также как шов Tang (Рисунок 56).
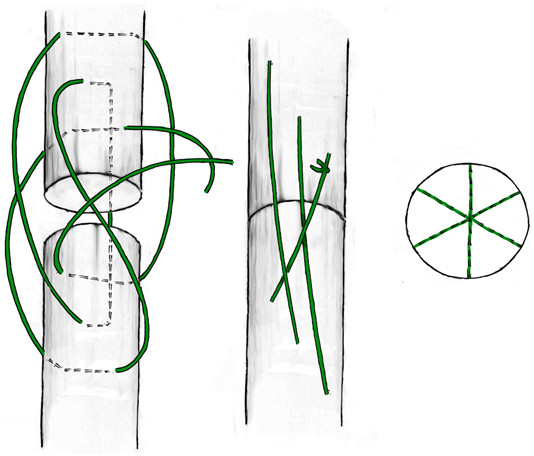
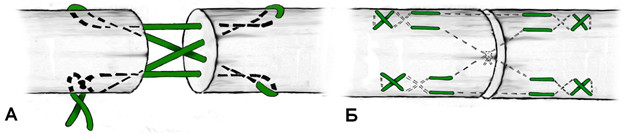
Кроме того, многие швы в своем составе имеют нити, пересекающие плоскость разрыва под углом. Наиболее простой представитель этого семейства сухожильных швов – крестообразный шов (Рисунок 57). Однако несложно заметить, что подобный маневр может быть совершен с практически любым сухожильным швом за счет модификации (например, модифицированный шов по Savage).
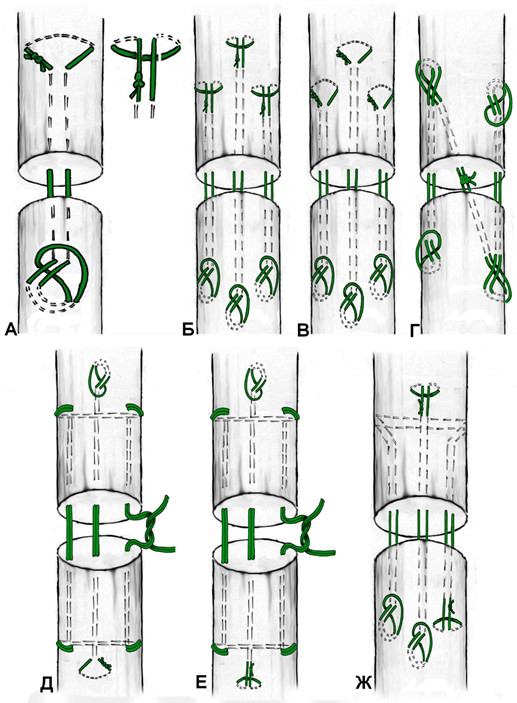
Кроме описанных сухожильных швов существует достаточно много и других разновидностей, однако, в силу разных причин, они не получили широкого распространения (Рисунок 58).
Все описанные швы подразумевают сопоставление культей сухожилия по типу «конец-в-конец». Такие виды сухожильных швов, как по Pulvertaft [648] и спиральный шов (Рисунок 59) для лечения разрывов ахиллова сухожилия не используются.
В тех случаях, когда разрыв сухожилия происходит ближе к энтезису и длина дистальной культи сухожилия не позволяет выполнить классический шов, восстановление целостности сухожилия может быть выполнено двумя способами: проведением шовного материала через канал в пяточной кости либо при использовании так называемых якорных фиксаторов (Рисунок 60). Мы считаем, что последний способ предпочтителен, так как он менее травматичен, а использование трех якорных фиксаторов позволяет максимально увеличить площадь контакта культи сухожилия с энтезисом. Нити же самих якорных фиксаторов проводятся сквозь сухожилие в соответствии с выбранным видом сухожильного шва.
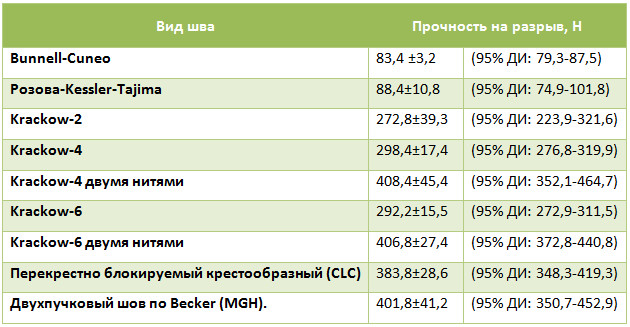
Наиболее распространены сухожильные швы по Bunnell и Kessler. Неудивительно, что изучению биомеханических характеристик именно этих швов посвящено большинство исследований. Watson и соавторы оценили прочность на разрыв шва Kessler в 85,24 Н, шва Bunnell – 93,18 Н (нить Ethibond №1) [787]. Yildirim и соавторы при исследовании тех же швов при использовании нити Ticron no. 5 оценили прочность шва Bunnell в 197 Н, а шва Kessler – в 101 Н (во всех случаях несостоятельность шва происходила за счет прорезывания нитей) [813]. В более позднем исследовании Yildirim и соавторы сравнили прочность тех же швов при использовании различных нитей, при этом были получены аналогичные показатели прочности на разрыв, и ни в одном случае не происходило разрыва самих нитей [814]. Zandbergen и соавторы сравнивали механическую прочность на разрыв открытого шва по Bunnell и чрескожного шва по Bunnell (т.е. по Ma и Griffith). В опыте нити проводились через канал в пяточной кости, а так же применялась якорная фиксация в кости. В качестве шовного материала использовались нити PDS no. 1 (открытый шов), а для чрескожного шва применялись нити PDS II no. 1 и Panacryl no. 1. Различия в прочности были незначимыми и варьировали от 166Н (якорная фиксация) до 195Н (нить, проведенная через канал в кости) и 211Н (открытый шов) [819].
Результаты работ, посвященные исследованию прочности сухожильного шва, достаточно сложно суммировать (Таблица 7). Исследователи используют многочисленные модификации различных швов и применяют разные нити. Несмотря на то, что практически все установки для биомеханического измерения, использовавшиеся авторами, сертифицированы по международным стандартам (ISO), один и тот же шов в руках разных исследователей может показать результаты прочности, отличающиеся в разы.
Таблица 7. Средние значения прочности на разрыв некоторых биомеханических исследований различных швов ахиллова сухожилия
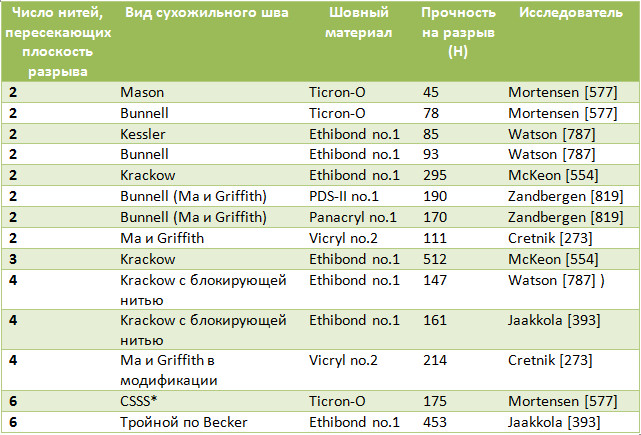
Существует точка зрения, что прочность скорее во многом зависит от состояния сухожильной ткани и от прочности самой нити, чем от способа ее проведения [57, 134]. Однако современный шовный материал может иметь прочность на разрыв до 5 тысяч Н и более. Одни авторы считают, что прорезывание будет тем больше, чем больше зигзагов и витков нити в ткани сухожилия [120]. Учитывая некоторую методологическую разнородность биомеханических исследований, интересны те работы, в которых авторы в идентичных условиях сравнивают большое число разных видов швов. К сожалению, таких работ немного. Например, M. D. Shaieb и D. I. Singer [699] при исследовании пяти разных швов выяснили, что наибольшей прочностью на разрыв и сопротивляемостью к расхождению обладает технически сложный шов по Savage (Рисунок 61).
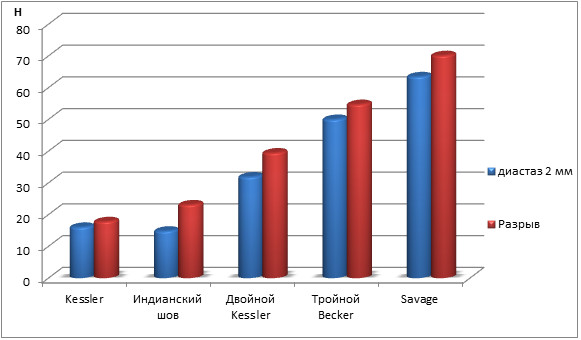
с блокирующей нитью, p<0,05 между группами с одной нитью). Таким образом, теоретически двухпетлевой шов по Krackow имеет такую же прочность, что и более экстенсивные швы. Однако, анализируя эти данные, стоит помнить о том, что in vivo концы сухожилия, располагающиеся близко к месту разрыва, дегенеративно изменены, причем характер и протяженность этих изменений далеко не всегда видны. Поэтому мы считаем, что шов Krackow, состоящий из двух блок-петель, рискует целиком оказаться в зоне дегенерации сухожилия, что приведет к несостоятельности фиксации. Ввиду этого, в клинических условиях стоит отдать предпочтение четырех- и шести петлевым швам по Krackow с добавлением блокирующей нити.
Однако эти абсолютные цифры имеют неполноценную клиническую значимость. Дело в том, что современные протоколы реабилитации пропагандируют функциональный подход, при котором сухожилие испытывает постоянную циклическую нагрузку, а в описанных выше работах авторы применяли только одноцикловую нагрузку (т.е. постепенно увеличивали силу на испытательной машине, регистрируя при этом расхождение концов сухожилия и прорезывание швов). Еще в 1983 году B. Nyström и D. Holmlund выяснили, что после сшивания ахиллова сухожилия происходит неизбежная сепарация его культей [603, 604]. При этом, сепарация носила не равномерный характер, а ступенчатый. Первый диастаз проявлялся в течение первых 4 дней послеоперационной иммобилизации, затем наступал период стабильности, а после 20 дня появлялся вторичный диастаз, по всей видимости обусловленный усталостным прорезыванием нитей в толще сухожилия [604]. Чтобы уменьшить эту сепарацию, ряд авторов предлагает использовать в сочетании с адаптирующими швами блокирующий съемный шов по Bunnell с проведением нити через неповрежденную мышечно-сухожильную часть и канал в пяточной кости или над пяточным бугром [229, 290, 388, 555, 780]. Однако такое техническое усложнение шва не пользуется популярностью и сопровождается значительной травматизацией сухожилия.
В связи с этим, особый интерес представляют те исследования, в которых авторы использовали полицикличную нагрузку на испытательных стендах. Нам удалось обнаружить только две таких работы [195, 371]. Benthien и соавторы [195] сшивали сухожилия четырехжильным швом по Krackow. В одной группе использовалась нить из полиэстера, а в другой – из полибленда (polyblend, нить CP-Fiber™, компания СP-Medical; полибленд – относительно новый материал, плетеные нити из которого хорошо зарекомендовали себя в ряде биомеханических исследований [186, 209, 815и др.]). Затем разные сшитые образцы подвергали циклической нагрузке силой 50, 75, 100 или 125 Н (3000 циклов), регистрируя при этом увеличение диастаза концов сухожилия. В результате было обнаружено, что диастаз через 3000 циклов при нагрузках 50, 75, 100 или 125 Н при сшивании нитью из полиэстера равнялся 3.0±0.8, 4.9±1.0, 7.2±0.9 и 7.9±0.8 мм соответственно, а при сшивании нитью из полибленда через 3000 циклов диастаз даже при силе 125Н равнялся 3.3±0.3 мм, что было значительно меньше (p<0,001). Средняя прочность на разрыв (во всех случаях несостоятельность происходила за счет развязывания узла нити) при использовании нити из полиэстера составила 222±19Н, а из полибленда — 582±49Н (p < 0.001) [195]. Таким образом, биомеханические свойства сшитого сухожилия во многом зависят не только от вида шва, но и от шовного материала.
Другое циклическое биомеханическое исследование было выполнено Herbort и соавторами [371]. Они сшивали образцы ахиллова сухожилия нитью PDS (0.7 mm) по Kessler и по Bunnell, после чего образцы подвергали циклической нагрузке (1000 циклов при 5 и 20 Н, скорость – 20 мм/с). В результате было обнаружено, что диастаз концов сухожилия при шве по Kessler составил 5.58±1.8 мм, а при шве по Bunnell — 5.96±1.9 мм (p>0,05). При этом, прочность на разрыв шва по Kessler оказалась традиционно ниже, чем у шва по Bunnell (192.768±51.26Н и 255.033±22.45Н соответственно).
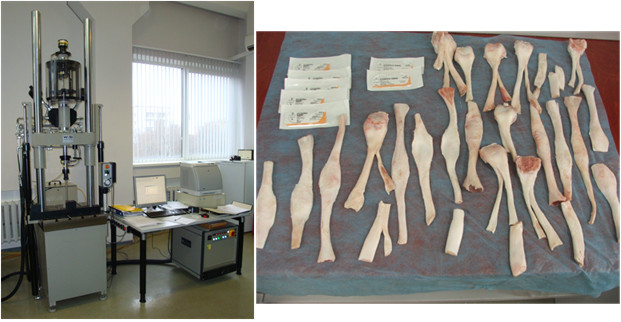
На наш взгляд, полициклические испытания ограниченного количества сухожильных швов не позволяют получить достаточного понимания в этом вопросе. В частности, авторы не выполняли сравнения полициклической стабильности одного и того же шва в зависимости от количества «мономеров» (ярусов), толщины нити, а само количество испытанных швов невелико. В связи с этим, мы выполнили собственное исследование в аккредитованной при Федеральном агентстве по техническому регулированию и метрологии испытательной лаборатории изделий ортопедо-травматологического назначения ФГУ ЦИТО им. Н.Н. Приорова Федерального агентства по высокотехнологичной медицинской помощи (Аттестат аккредитации РОСС RU.0001.22 ИМ21 на техническую компетентность в соответствии с требованиями ГОСТ Р ISO/МЭК 17025-2000, международного стандарта ИСО/МЭК 17025-1999 от 13 августа 2007 года). Исследование выполняли на универсальной испытательной машине Walter+Bai AG. Материалом исследования послужили подвергавшиеся замораживанию ахилловы сухожилия человека с костным блоком, а также сухожилия икроножной мышцы и сухожилие поверхностного сгибателя пальцев теленка (Рисунок 62).
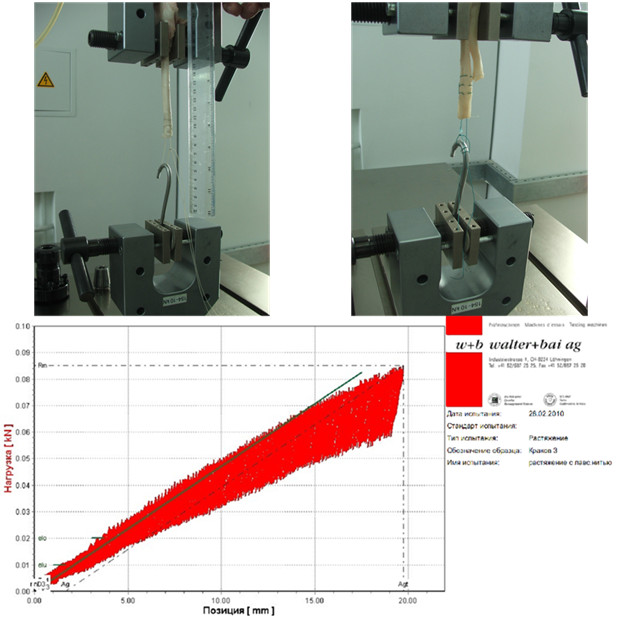
Опыт состоял из трех частей: на первом этапе мы сравнивали прочность шва на свежем и свежезамороженном сухожилии. На втором этапе мы изучали абсолютную прочность на разрыв различных сухожильных швов и на третьем этапе выполняли собственно полициклические испытания (Рисунок 63).
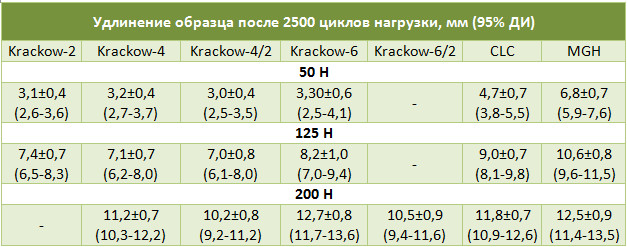
Сухожилие прошивали нитью Ethibond №1. Исследовались следующие виды швов: Bunnell-Cuneo; Розова-Kessler-Tajima; Krackow с одним «ярусом» петель, состоящим из двух петель (Krackow-2), Krackow с двумя «ярусами» петель (Krackow-4); Krackow с тремя «ярусами» петель (Кrackow-6); блокируемый крестообразный шов (CLC) , двухпучковый шов по Becker (MGH).
Для определения прочности на разрыв сухожилие, прошитое тем или иным способом, помещали в испытательную машину, после чего равномерно увеличивали силу растяжения образца. Сила, которая регистрировалась при удлинении образца более чем на 15 мм или разрыве нити, считалась равной прочности на разрыв (Таблица 8). Для исследования полициклической стабильности было выполнено три серии с различными нагрузками. К сухожильным швам циклично прилагали усилия в 50, 125 и 200 Н. Заданная скорость растяжения образца равнялась 2,5 см/с. Частота циклов – 4 Гц. После 2500 циклов регистрировалось удлинение образца (Таблица 9).
В результате эксперимента было сделаны следующие выводы:
1. Биомеханические свойства ахилловых сухожилий человека и сухожилий телят, подвергавшихся замораживанию, незначительно отличаются от свойств свежих сухожилий, что позволяет использовать такие сухожилия в качестве моделей для биомеханических исследований.
2. Прочность швов по Bunnell-Cuneo и Kessler зависит в большей степени от устойчивости сухожилия к деформации и прорезыванию и уступает прочности современных швов (Krackow, MGH, CLC), зависящей в первую очередь от прочности самой нити и количества нитей, пересекающих плоскость разрыва сухожилия.
3. Прочность сухожильного шва увеличивается при увеличении количества нитей, пересекающих плоскость разрыва, и не зависит от количества мономеров сухожильного шва, увеличивающихся свыше определенного количества, равняющегося для шва Krackow 2.
4. Увеличение «мономеров» сухожильного шва увеличивает удлинение сухожильного шва при приложении к нему полициклической нагрузки, снижая таким образом его полициклическую стабильность.
5. Наибольшую полициклическую стабильность показал шов Krackow с двумя ярусами петель. Между ним и швом Krackow с тремя ярусами петель достоверного различия по параметрам полициклической стабильности не выявлено, однако последний подвержен меньшему риску быть наложенным на дегенеративно измененное сухожилие за счет удаления ярусов петель от плоскости разрыва.
6. Наименьшую полициклическую стабильность показали швы Bunnell-Cuneo и Розова-Kessler-Tajima.
Швы Bunnell-Cuneo и Розова-Kessler-Tajima в серии испытаний с нагрузкой 50 Н показали несостоятельность сухожильного шва вследствие прорезывания сухожилия шовным материалом в 60% случаев, шов Krackow-2 с нагрузкой 200 Н – в 40% в связи с чем среднюю величину удлинения сухожильного шва не рассчитывали. Испытание шва Kracow-6/2 выполнялось как дополнительное, испытание с нагрузкой 50 и 125 Н не проводилось из-за очевидной способности шва противостоять большим нагрузкам.
Несмотря на ценность полициклических исследований, эти цифры трудно трансполировать на реальные клинические условия, и, в частности, нам не известно, какая прочность шва будет достаточной, а какая – избыточной. В медицинской литературе встречаются исследования, посвященные изучению сил, испытываемых ахилловым сухожилием при нормальной ходьбе и при иммобилизации в положении 0 и 10 градусов плантарной флексии [140]. Но в большинстве случаев в послеоперационном периоде иммобилизация выполняется в положении плантарной флексии более 30 градусов, для которого неизвестны биомеханические нагрузки, испытываемые сухожилием.
По мнению некоторых авторов, швы по Bunnell являются «золотым стандартом» оперативного лечения свежих разрывов ахиллова сухожилия [204]. Такое мнение было вполне логичным, учитывая предыдущие биомеханические исследования, показавшие неоспоримое преимущество шва по Bunnell над швом по Kessler. Однако результаты полициклических биомеханических тестов, выполненных Herbort и соавторами [371], возможно дадут шву по Kessler при разрывах ахиллова сухожилия «вторую жизнь», поскольку по сравнению со швом по Bunnell он гораздо менее травматичен. Помимо этого, при осевой нагрузке поперечные нити шва по Bunnell деформируют сухожильные волокна, что вероятно ухудшает микроциркуляцию [198]. Созвучная мысль о неэффективности сложных швов была высказана и в единственном обнаруженном нами клиническом исследовании, в котором авторы сравнивали эффективность разных сухожильных швов. В проспективном рандомизированном исследовании 51 пациента под руководством Mortensen 1992 [578] использовался шестижильный шов и шов по Mason. В ходе операции в проксимальную и дистальную культи сухожилия имплантировали рентгенконтрастные маркеры. Вне зависимости от вида шва (p>0,05) сепарация культей сухожилия через 7 недель после операции составила 10,5 мм.
Тем не менее, наиболее часто для сшивания свежих разрывов ахиллова сухожилия применяются швы по Bunnell, по Krackow и двойной или тройной по Becker, а так же их многочисленные модификации.
Немаловажен и шовный материал, которым выполняется шов ахиллова сухожилия. Традиционно хирурги предпочитают использовать нерассасывающиеся плетеные нити, некоторые из которых даже оказывают благоприятное влияние на гистогенез неосухожилия [564]. Очевидным минусом нерассасывающегося шовного материала является то, что он остается в сухожилии постоянно и может служить потенциальной причиной целого ряда проблем (тендиниты, нарушение морфологии сухожилия, снижение васкуляризации, нарушение скользящих свойств и др). В связи с этим представляются интересными те работы, в которых изучается вопрос использования биодеградируемого шовного материала. Однако число таких работ невелико, а их результаты Нпротиворечат друг другу. Например, турецкие хирурги Bekler и Beyzadeoğlu выполнили сшивание ахиллова сухожилия нитью Vicryl открытым способом у четырех пациентов. В послеоперационном периоде у всех этих пациентов имелось асептическое отделяемое из раны, в результате были выполнены ревизионные операции по удалению остатков нити. Авторы отметили, что использование толстого рассасывающегося материала может служить источником потенциальной опасности ввиду отторжения и/или контаминации полифиламентной нити [189]. C другой стороны, Bertelli и соавторы сообщили о результатах лечения 20 пациентов с застарелыми разрывами, которым они выполняли чрескожный восьми-образный шов нитью Vicryl. Авторы не отметили ни одного случая реруптуры или повреждения икроножного нерва, а среднее значение по шкале AOFAS составило 99,0 баллов [201]. На наш взгляд, работа Bertelli и соавторов имеет ряд существенных ограничений (непроспективное, неконтролируемое исследование), и конфликтующие результаты с работой Bekler и Beyzadeoğlu пока не позволяют рекомендовать использование рассасывающегося материала для сшивания ахиллова сухожилия.
Результаты многочисленных исследований патофизиологии мышечной ткани и влияния на нее иммобилизации и тенотомии убедительно доказывают, что для полной реституции функциональной способности мышечно-сухожильного комплекса после разрыва сухожилия наряду с восстановлением длины и сращением сухожилия необходима ранняя деятельность мышцы. Величина мышечных усилий, однако, не должна превышать прочности сухожильного соединения.
Открытые хирургические вмешательства
Для оперативного лечения разрывов ахиллова сухожилия предложено большое число способов, варьирующих от простого сшивания по типу конец-в-конец по Bunnell или Kessler до более сложных вмешательств, дополняемых пластикой или армированием сухожилия [716]. Могут использоваться искусственные сухожильные имплантаты, изготовленные из биодеградируемого карбона [619], сетки Marlex (связана из монофиламентных полипропиленовых нитей) [382, 610] и коллагеновые сухожильные протезы [422]. При сшивании по Bunnell по типу конец-в-конец, которое может быть выполнено под местной анестезией [697], в качестве шовного материала могут использоваться сосудистые протезы из дакрона [491]. В исследованиях было обнаружено, что дакрон позволяет сблизить разорванные концы сухожилия с меньшим натяжением по сравнению с другими стандартными нитями [491] и способствует росту фиброзной ткани [564]. Однако, с другой стороны, для формирования нормального коллагена необходима именно циклическая нагрузка по оси сухожилия [547]. Следовательно, недостаточное натяжение сухожилия при его сшивании может быть недостатком.
Первичное армирование при свежем разрыве ахиллова сухожилия
Некоторые авторы являются сторонниками первичного армирования [739] при шве ахиллова сухожилия с использованием сухожилий m. plantaris [507, 652], m. peroneus brevis [744], одного центрального низведенного икроножного фасциального лоскута [217] или двух таких лоскутов (медиального и латерального) [494].
Пионером первичного армирования при свежих разрывах ахиллова сухожилия можно считать Lynn [507], работа которого была опубликована в The Journal of bone and joint surgery в 1966 году. Автор рекомендовал выполнять операцию следующим образом. Разрез кожи длиной 12,5 – 17,5 см делают параллельно медиальному краю ахиллова сухожилия (Рисунок 64).
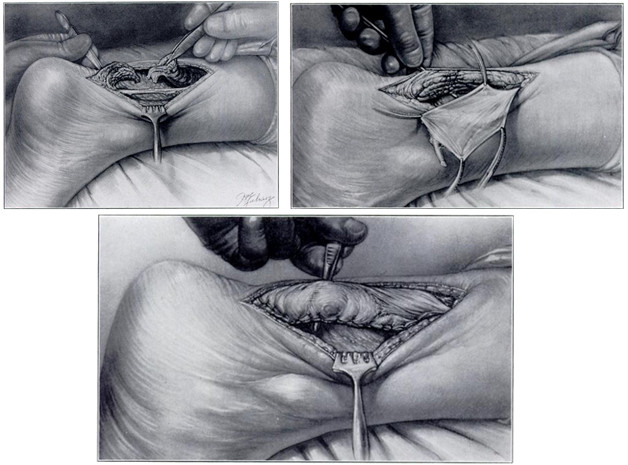
Вскрывают паратенон и выделяют разорванные концы сухожилия. Дегенеративно измененные концы сухожилия не иссекают. В эквинусном положении стопы (20 градусов) выполняют шов сухожилия нерассасывающейся нитью по типу «конец-в-конец». Если имеется интактное сухожилие m. plantaris, то его отделяют от места прикрепления к пяточной кости. Затем отделенное сухожилие распластывают подручным инструментом так, чтобы оно приняло максимально плоскую форму. Распластанное сухожилие m. plantaris подшивают поверх места шва ахиллова сухожилия, укрывая его. Если это будет возможным, целесообразно укрыть этой мембраной место шва в 2,5 см проксимальнее и дистальнее места шва ахиллова сухожилия. В тех случаях, когда сухожилие m. plantaris окажется разорванным, то его так же распластывают, но используют как свободный аутотрансплантат.
В 2004 году Bluman и соавторы предложили использовать сухожилие m. plantaris как дополнительный шовный материал (Рисунок 65). Сухожилие проводили сквозь толщу ахиллова сухожилия с помощью проводника Hewson. Методика была апробирована авторами у 7 пациентов [211].
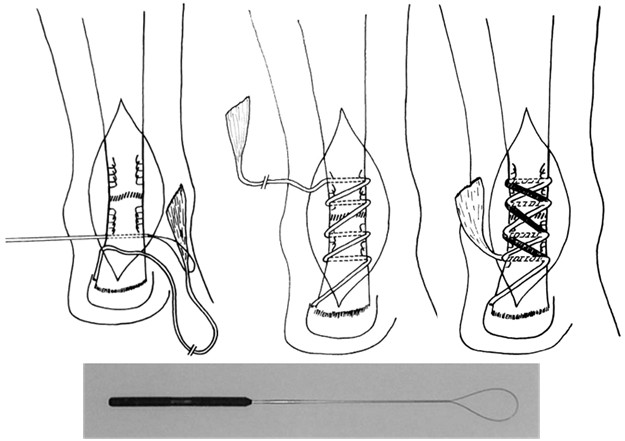
Однако нет доказательств преимущества первичного армирования при шве свежих разрывов ахиллова сухожилия над простым сшиванием по типу «конец-в-конец» [398]. Нам удалось обнаружить две проспективные рандомизированные работы, посвященные изучению первичного армирования.
В исследование Ari Pajala и соавторов вошло 60 пациентов со свежими разрывами ахиллова сухожилия, которые были разделены на две группы до операции. В первой группе выполнялось сшивание сухожилия по Krackow, а во второй группе шов дополнялся пластикой по Silfverskiöld [705]. В результате авторы обнаружили, что первичное армирование достоверно удлиняло время операции в среднем на 25 минут, увеличивало протяженность разреза на 7 см (p < 0.001 для обоих показателей), при этом преимуществ по частоте реруптур и функциональным результатам не было [615].
В работе S. Aktas и соавторов [143] была выполнена рандомизация 30 пациентов. Во всех случаях выполнялось сшивание сухожилия по Krackow [456], но в 1 группе (16 пациентов) шов дополняли пластикой по Lynn [507] (Рисунок 66). В среднем через 18,8 месяцев результаты по шкале AOFAS составили 96,7 баллов в 1 группе и 98,8 баллов – во второй (p>0,05)
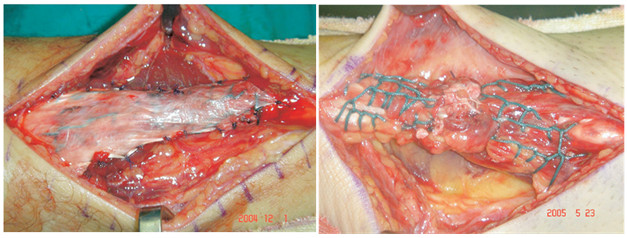
T. Nyyssönen и соавторы [605] провели ретроспективное исследование, в ходе которого сравнили результаты лечения 98 пациентов со свежими разрывами ахиллова сухожилия. 59 пациентам выполняли первичное армирование по методу Lindholm (1959), Lynn (1966) или Silfverskiöld (1941), а оставшимся 39 пациентам выполняли непосредственное сшивание по типу «конец-в-конец». Группы не различались по частоте реруптур, по функциональным и субъективным результатам. При этом частота осложнений в группе первичного армирования была большей. В 2003 году Zell and Santoro [822] по результатам неконтролируемого исследования 25 пациентов со свежими разрывами, которым они выполняли первичное армирование низведенным лоскутом, предположили, что такая пластика позволяет получить более крепкое сухожилие, и таким образом, ускорить восстановление пациентов. Однако в исследовании T. Nyyssönen и соавторов [605] иммобилизация пациентов в группе первичного армирования в среднем длилась больше на одну неделю (p<0,05).
В связи с этим вполне разумно отказаться от первичной пластики при свежих разрывах. Например, Mafulli и соавторы рекомендуют выполнять армирование сухожилия только при лечении застарелых или повторных разрывов [514].
Чрескожный шов
Ma и Griffith [508] разработали методику чрескожного шва ахиллова сухожилия, которая является своего рода компромиссом между консервативным и открытым оперативным лечением.
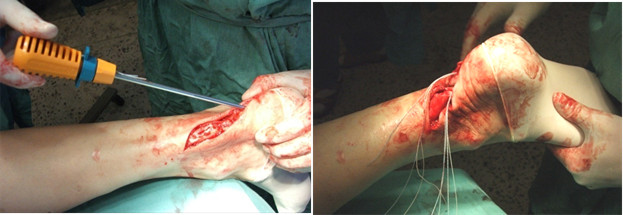
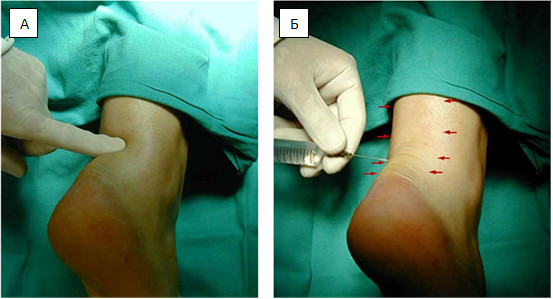
Операция выполняется под местной, регионарной или общей анестезией, с полноценной обработкой операционного поля, с соблюдением всех правил асептики и антисептики. Пальпаторно определяют место разрыва ахиллова сухожилия (Рисунок 67) и, отступя от него по 2,5 см в проксимальном направлении, выполняют два разреза с медиальной и латеральной стороны от сухожилия длиной не более одного сантиметра. Экономно отделяют паратенон от подкожно-жировой клетчатки и затем на прямой хирургической игле сквозь толщу сухожилия проводят нерассасывающуюся нить толщиной №0 или №1. Вкол иглы выполняют с латеральной стороны, чтобы не повредить икроножный нерв (Рисунок 68 Шаг 1.).
Затем каждый конец нити при помощи прямой иглы проводят сквозь сухожилие под углом к его оси примерно в 45 градусов, выводя их в области краев торцов проксимальной культи сухожилия. Определяют место выхода иглы из толщи сухожилия и в этом месте выполняют надрез кожи и подкожно-жировой клетчатки скальпелем (Рисунок 68 Шаг 2.). Через эти проколы выводят наружу оба конца нити.
Далее конец нити, выведенный латерально, продевают сквозь ушко изогнутой режущей хирургической иглы и, сквозь ту же кожную рану, проводят нить к дистальной культе сухожилия, стараясь погрузить ее под паратенон и вывести нить с латеральной стороны дистальной культи сухожилия примерно посередине ее длины (Рисунок 68 Шаг 3). Аналогичным образом в месте выхода иглы разрезают кожу скальпелем и, выполнив экономную диссекцию паратенона от подкожно-жировой клетчатки, выводят нить из раны (Рисунок 68 Шаг 4).
Затем этот же конец нити продевают сквозь ушко прямой хирургической иглы и прошивают ею дистальную культю сухожилия перпендикулярно его оси, опять же выполнив прокол кожи скальпелем в месте выхода иглы по медиальному краю сухожилия (Рисунок 68 Шаг 5 и 6). Далее нить проводят на изогнутой хирургической игле от дистальной культи сухожилия к проксимальной, стараясь выполнить это под паратеноном (Рисунок 68 Шаг 7). Теперь, когда оба конца нити выведены через одну и ту же рану с медиального края сухожилия, стопе придают эквинусное положение и связывают нити между собой, устраняя диастаз. Срезают концы нитей и погружают узел вглубь раны под паратенон (Рисунок 68 Шаг 8 и 9). Если размеры разрезов кожи не превышают одного сантиметра, то накладывать швы необязательно, достаточно только лишь стерильной повязки. Сразу после операции конечность иммобилизируют передней лонгетой от верхней трети голени до основания пальцев стопы в положении гравитационного эквинуса на 4 недели, после чего иммобилизации еще в течение 4 недель выполняют нагрузочным брейсом.
Методика была апробирована авторами на относительно небольшой группе из 19 пациентов. Осложнения были представлены только двумя случаями небольших краевых некрозов, а повторные разрывы отсутствовали.
Rowley и Scotland [668] описали результаты лечения 24 пациентов, у 14 из которых (I группа) применялось консервативное лечение путем иммобилизации в эквинусном положении, а у 10 пациентов (II группа) выполнили чрескожный шов. У одного пациента из II группы развился дефицит n. suralis в результате его подшивания, но других осложнений в группе отмечено не было. Восстановление силы плантарной флексии, равно как и скорость восстановления повседневной активности, были лучшими во II группе.
Хирурги, опробовавшие эту методику, рекомендуют ее для применения при свежих разрывах у спортсменов [72, 221, 364]. Многие авторы пытались модифицировать чрескожный шов по G.W.C. Ма и Т.О. Griffith [508]. Например, отечественные хирурги С.Г.Гиршин и И.С.Цыпин (1981) предложили использовать аналогичным образом шов Bunnell-Cuneo (Рисунок 69) [29, 111, 126].
В 2004 году Сretnik и соавторы предложили практически идентичную методику (Рисунок 70) [272]. Как видно, технология чрескожного шва мало отличается от предложения С.Г.Гиршина и И.С.Цыпина.
Предлагались и иные модификации чрескожного шва: гарпунная тенораффия [285] и методика Webb-Bannister (Рисунок 71) [789]. Методика Webb-Bannister исключает повреждение икроножного нерва, однако ее биомеханические характеристики невысоки [779].
Несмотря на всю привлекательность такого малоинвазивного метода, как чрескожный шов, он не лишен целого ряда существенных недостатков. Klein и соавторы [446] отметили прошивание n. suralis в 13% случаев (из 38 пациентов). Hockenbury и Johns [376] на свежезамороженном трупном материале выполнили сравнение in vitro чрескожного шва ахиллова сухожилия и открытого шва ахиллова сухожилия после поперечной тенотомии. Образцы были разделены на две группы по пять в каждой. В первую группу вошли образцы, сшитые открыто по Bunnell, а во вторую – сшитые чрескожно по методике Ma и Griffith [508]. Амплитуда дорсифлексии стопы, при которой имело место расхождение сшитых концов сухожилия на 10 мм, в первой группе была вдвое большей, чем во второй (в среднем 27,6 градусов и 14,4 градусов соответственно; p < 0,05). Прошивание n. suralis во второй группе произошло в трех случаях из пяти. Несоответствие сшитых чрескожно культей сухожилия по ширине имело место в четырех случаях из пяти. На основе полученных данных можно сделать вывод о том, что чрескожный шов имеет высокий риск повреждения n. suralis и позволяет первично получить примерно только лишь 50% от прочности открытого шва. Кроме того, чрескожно сшитое сухожилие тоньше, чем после открытого шва, что в ряде случаев может служить причиной эстетического неудовлетворения пациента [221]. В целом, практически во всех исследованиях авторы отмечают значительно большую частоту реруптур после чрескожного шва по сравнению с открытым швом [154, 221]. Кроме того, высока частота прошивания n. suralis [376, 668, 720], что приводит к персистентным парастезиям и необходимости выполнения невролиза [312, 446]. Кроме того, описывались такие осложнения как образование рубцовых втяжений кожи и гранулем в области погружения нитей и узлов [508]. К сожалению, не исключена возможность формирования лигатурных свищей [126].
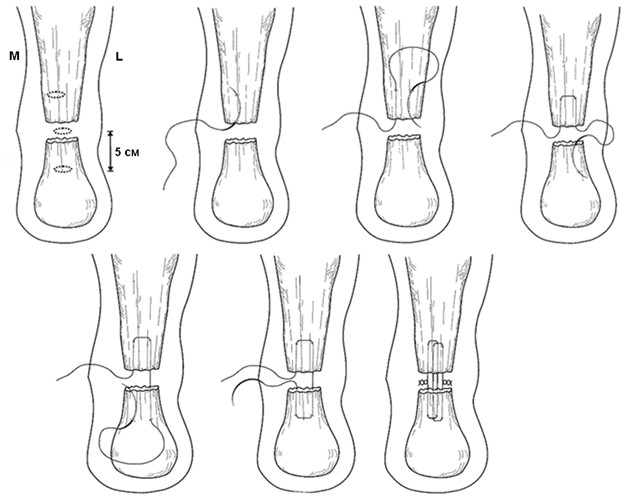
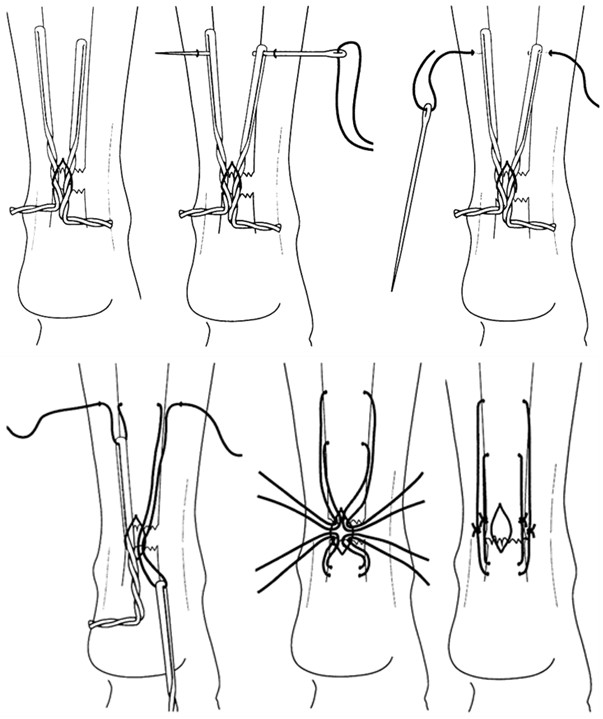
Проблему рубцовых спаек сухожилия и лигатурных свищей можно решить путем наложения чрескожного удаляемого шва. Способ чрескожного удаляемого шва ахиллова сухожилия впервые разработан А.П. Трачуком в соавторстве с В.С.Дедушкиным и А.Н.Ероховым (Патент на изобретение N 2008833 от 15.3.94 г.) [121]. Методика заключается в следующем: шовную нить проводят чрескожно (без разреза кожи и обнажения сухожилия) через проксимальный конец сухожилия крестообразно, выводя концы нити на боковые поверхности сухожилия и далее под кожей вдоль дистального конца сухожилия и боковых поверхностей пяточной кости на пяточную область, где с натяжением фиксируют на гипсовой прокладке. В качестве шовной нити авторы рекомендуют использовать капроновую мононить (леску) диаметром 0.7 мм, которую в последующем удаляют из сухожилия пересечением одного ее конца и тягой за другой (Рисунок 72).
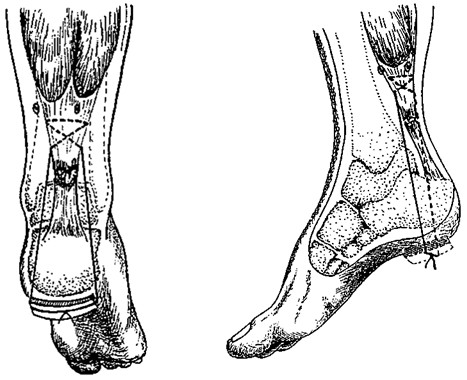
К сожалению, некоторая языковая оторванность отечественной медицины приводит к тому, что многие наши наработки незаслуженно не упоминаются иностранными авторами. Например, в 2002 году в весьма известном и уважаемом журнале Foot and Ankle Surgery вышла работа C. Chillemi и соавторов, которые предлагали практически идентичную методику удаляемого чрескожного шва (Рисунок 73) [258]. Даже при внимательном сравнении описания предложенных способов мы не смогли обнаружить существенных отличий.
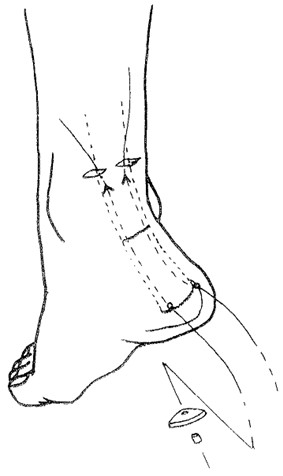
Энтузиасты метода продолжали совершенствовать чрескожный шов. R. Flavin предложил сгибать конечность в коленном суставе и супинировать стопу, что приводит к натяжению икроножного нерва и появлению возможности пальпаторно определить его локализацию [313]. К сожалению, этот метод в реальных клинических условиях мало применим, поскольку конечность зачастую отечна. Michael R. Carmont и Nicola Maffulli предложили выполнять разрезы для проведения чрескожных нитей параллельно ходу нерва, а дистальную культю сухожилия прошивать через проколы, смещенные кзади (Рисунок 74). Кроме того, авторы предложили в области разрыва сухожилия делать дополнительный поперечный разрез, через который выполняется мобилизация культей сухожилия от окружающих структур, в том числе и от икроножного нерва. В таком случае появляется возможность более точно сопоставить концы разорванного сухожилия и минимизировать риск повреждения икроножного нерва. Кроме того, авторы выполняли чрескожный шов под местной инфильтрационной анестезией, что позволяло после каждого проведения нити переспрашивать пациента о боли и парестезии, связанных с повреждением икроножного нерва. По данным авторов, которые применили данную методику более чем у ста пациентов, неврологических осложнений отмечено не было [240].
Минимизации осложнений чрескожного шва пытались добиться и путем совершенствования инструментов. Еще в 1985 году M. Kakiuchi предложил выполнять чрескожный шов ахиллова сухожилия, протаскивая нить по поверхности сухожилия скрученной спицей Киршнера, что минимизировало вероятность прошивания икроножного нерва и адгезию паратенона и сухожилия (Рисунок 75) [411]. За 10 лет эта методика была применена автором у 20 пациентов и позволила получить лучшие функциональные и эстетические результаты по сравнению с традиционным открытым швом.
Кроме того, чрескожный шов может быть выполнен по гарпунной методике. Гарпунный принцип подразумевает наличие на нити блокирующего фиксатора, который предотвращает протаскивание нити сквозь сухожилие при осевой нагрузке. Впервые гарпунный принцип был предложен P. Delponte и соавторами в 1989 году – на нить нанизывался 5 мм гарпун. По данным авторов, которые применили эту методику у 57 пациентов, частота реруптур составила 3,5% [284].
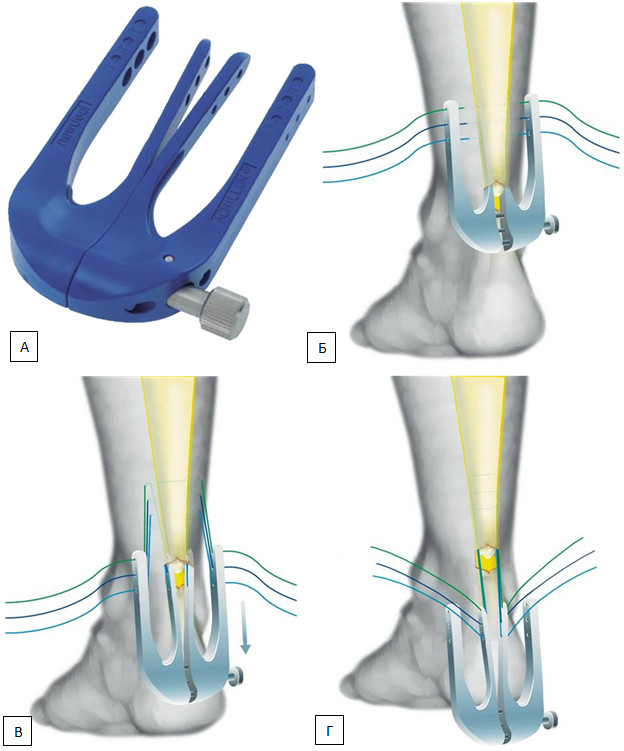
Современным продолжением гарпунной методики является система чрескожного удаляемого шва Tenolig [741], на одних концах нити которой имеются пластиковые гарпуны, а другие концы нити выводятся на кожу и фиксируются пластиковыми пуговицами (Рисунок 77). Нам известно три работы, в которых авторы применяли систему Tenolig [146, 337, 509], причем одна из них – проспективная рандомизированная [337]. Стоит отметить, что все авторы, использовавшие систему Tenolig, характеризовали ее как новую для ахиллова сухожилия. Однако еще в 1999 году вышла работа O. Gorschewsky и соавторов [345], которые применили идентичную методику с использованием кустарно изготовленных фиксаторов типа Lengemann для лечения 20 пациентов со свежими разрывами и получили отличные результаты у 19 (95%) пациентов. По всей видимости, имеет место некоторое лоббирование со стороны фирмы-производителя системы Tenolig, что вынуждает нас относиться к результатам даже проспективного рандомизированного исследования [337] с настороженностью.
Эндоскопические методы
Современной тенденцией хирургии является внедрение малоинвазивных методов, в том числе и эндоскопических. Вполне логично, что предпринимались попытки сшивания разорванного ахиллова сухожилия под эндоскопическим контролем. Предполагается, что основным преимуществом эндоскопического пособия является снижение вероятности повреждения икроножного нерва и более точное сопоставление торцов культей сухожилия. Впервые сшивание ахиллова сухожилия под эндоскопическим контролем у одного пациента выполнил H. Thermann в 2001 году [748]. Следующая работа (2002 год) принадлежит A. Turgut и соавторам [769], которые после отработки методики на трупном материале применили эндоскопическое пособие у 11 пациентов. К сожалению, авторы не привели анализ результатов по общепринятым шкалам оценки. T. Halasi и соавторы (2003 год) привели результаты непроспективного исследования применения эндоскопического пособия у 67 пациентов с разрывами ахиллова сухожилия. К сожалению, методологическое качество работы было невысоким, но, тем не менее, авторы зарегистрировали несколько меньшую частоту реруптур в эндоскопической группе за счет более точной адаптации торцов сухожилия [360]. Позже, в 2007 году, вышла совместная проспективная работа K. Tang и H. Thermann, обобщившая результаты лечения 20 пациентов с применением эндоскопического пособия [735]. Авторы под эндоскопическим контролем выполняли дебридмент концов сухожилия и накладывали шов по Kessler. Результаты прослежены в течение 12 месяцев, по шкале Lindholm у 15 пациентов были получены отличные и у 5 пациентов – хорошие результаты. В 2008 году были опубликованы результаты проспективного исследования A.P. Fortis и соавторов, применивших эндоскопический шов ахиллова сухожилия у 20 пациентов. Средний результат по шкале Merkel составил 604 балла [318].
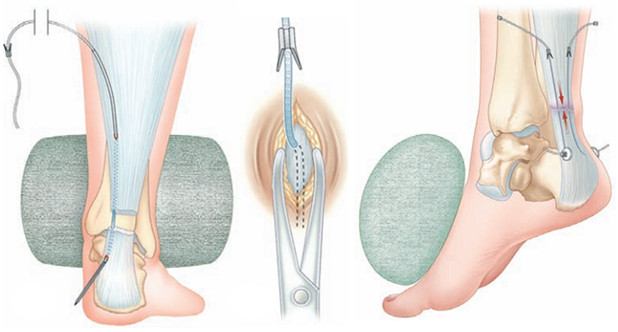
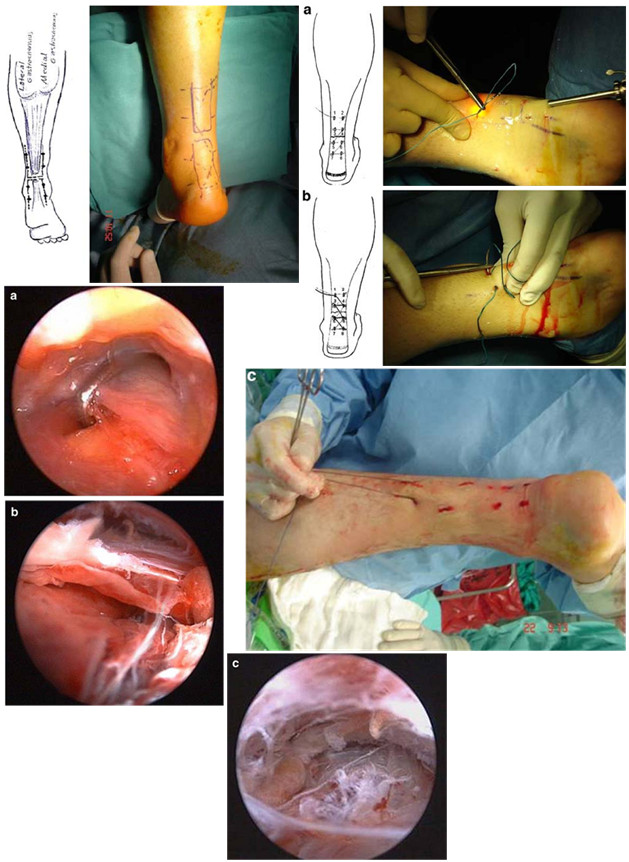
Весьма богатым опытом (62 пациента) эндоскопического шва ахиллова сухожилия обладают Doral M.N. и соавторы, работа которых была опубликована в августовском номере журнала Archives of Orthopaedic and Trauma Surgery (2009 год) [296]. Средняя оценка по шкале AOFAS составила 94,6 баллов, а случаев реруптур, тромботических и инфекционных осложнений авторы не наблюдали. Doral M.N. рекомендует следующую технику операции: пациент лежит на животе. Операция выполняется под местной инфильтрационной анестезией. Обескровливающий жгут и периоперационная антибиотикопрофилактика не показаны. До начала операции маркером отмечают локализацию разрыва. Затем, с целью уменьшения кровотечения из порталов проксимальнее (примерно на 5 см) и дистальнее (примерно на 4 см) пальпируемого диастаза концов сухожилия, выполняют инфильтрацию кожи и подлежащих тканей 20–50 мл физиологического раствора с анестетиком (1% Citanest® 5 mL + 0.5% Marcain® 5 mL) в области планируемых восьми порталов (4 с медиальной и 4 с латеральной стороны, Рисунок 78). В последующем через эти порталы не только вводят эндоскопическое оборудование и инструментарий, но и проводят нити. Особое внимание уделяется латеральному краю ахиллова сухожилия, поскольку здесь располагается икроножный нерв. Пациента предупреждают о том, чтобы он сразу сообщил оператору о возникновении боли или парестезий в области иннервации икроножного нерва как в ходе анестезии, так и в процессе самого оперативного вмешательства. Если таковое происходит, то портал смещают на 0,5-1 см по направлению к средней линии. Стопе поврежденной конечности придают эквинусное положение (15 градусов плантарной флексии). Через дистальный медиальный портал вводят эндоскоп с оптикой 30°, осматривают сухожилие и паратенон. После идентификации места разрыва сухожилия оценивают целостность окружающих тканей и их васкуляризацию. Осматривают торцы культей сухожилия. При необходимости торцы сухожилий освежают мягкотканым шейвером. Затем приступают к сшиванию ахиллова сухожилия под эндоскопическим контролем. Целесообразно использовать нить Ethibond No. 5 или PDS No. 5 (Ethicon Inc, Johnson & Johnson, Somerville, NJ, USA). Авторы рекомендуют использовать модифицированный шов по Bunnell.
Иглу с нитью PDS или Ethibond сначала вводят через верхнемедиальный портал (обозначен как ‘1’). При этом пальпируют ахиллово сухожилие между большим и указательным пальцами противоположной руки, чтобы удостовериться в том, что игла прошла через всю толщу сухожилия. Первую нить проводят перпендикулярно длиннику сухожилия и вытаскивают иглу через верхнелатеральный портал (обозначен как ‘2’). Затем иглу разворачивают и через тот же верхнелатеральный портал вводят в сухожилие, вытаскивая ее портал ‘3’. Процедуру повторяют, проводя нить в дистальном направлении из портала ‘3’ в ‘4’, затем из ‘4’ в ‘5’, из ‘5’ в ‘6’, из ‘6’ в ‘7’, и из ‘7’ в ‘8’ – наиболее дистальный латеральный портал. После этого иглу опять вводят в портал ‘8’ и выводят из портала ‘5’. Затем повторяют описанную последовательность в обратном порядке в направлении от дистального к проксимальному, в конечном итоге выведя нить в верхнемедиальный портал ‘1’ (обозначен как ‘1’).
На каждом этапе проведения нити эндоскоп вводят в различные порталы так, чтобы визуализировать сухожилие от его медиального до латерального края. Эндоскопически оценивают адекватность расположения нитей в толще сухожилия – в противном случае они легко прорежутся при затягивании нитей. Кроме того, эндоскопически оценивают качество сопоставления культей.
Наконец приступают к завязыванию нитей через верхнемедиальный портал. При этом стопа находится в нейтральном положении, что позволяет оценить сопоставление культей эндоскопически. До того, как завязать узел, пациента просят выполнить активную дорсифлексию и плантарную флексию стопы при согнутой конечности в коленном суставе под прямым углом. Благодаря этому маневру происходит проскальзывание непротянутых участков нити в толще сухожилия. После этого узел завязывают окончательно и погружают его под паратенон. Порталы закрывают стягивающими лейкопластырными наклейками. Раны не дренируют. В послеоперационном периоде авторы рекомендуют иммобилизацию нагрузочным брейсом в нейтральном положении минимум на 3 недели с последующей реабилитационной программой.
Применение видеоассистированных методик для сшивания ахиллова сухожилия весьма трудоемко и требует от хирурга длительного обучения и опыта эндоскопических вмешательств на конечностях. Например, T.Halasi и соавторы сообщают, что первые 10 попыток эндоскопического шва закончились неудачей, и им пришлось перейти к традиционному сшиванию ахиллова сухожилия [360]. Под эндоскопическим контролем обычно выполняется чрескожный шов, однако T.H. Lui дополнил его первичным армированием сухожилием подошвенной мышцы на дистальном основании [503]. Более того, в литературе имеется и единственное сообщение того же автора о применении эндоскопической методики для лечения застарелого разрыва ахиллова сухожилия с пластикой места разрыва сухожилием сгибателя большого пальца у трех пациентов [502].
F. Michels сообщил об одном случае эндоскопического сшивания частично разорванного ахиллова сухожилия у пациента с деформацией Haglund, которая и послужила причиной разрыва. Авторы выполнили эндоскопическую кальканеопластику, резецировав часть верхней поверхности бугра пяточной кости и сшили ахиллово сухожилие при помощи нитей и якорных фиксаторов (Рисунок 79) [565].
Тем не менее, в настоящее время отсутствуют крупные проспективные исследования, и нет ни одного рандомизированного исследования, в котором бы подтверждалось преимущество эндоскопической техники по функциональным результатам и частоте осложнений.
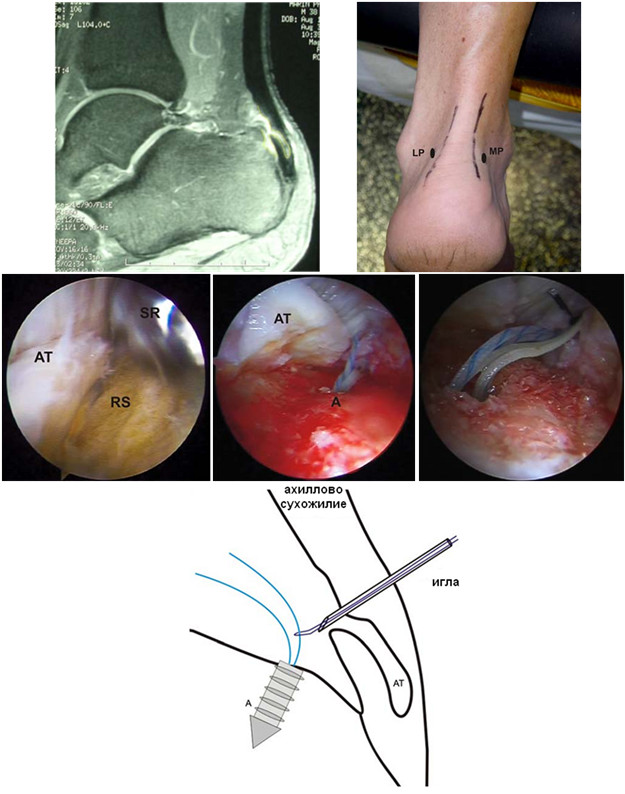
Фибриновый клей
Идея использования сворачивающихся субстанций для обеспечения гемостаза при лечении различных ран была предложена Bergel еще в 1909 году, когда он впервые описал это свойство фибрина [197]. В 1940 году Young и Medawar [816] в экспериментальных условиях склеили с помощью фибринового клея нерв. Однако прочность такого соединения оказалась небольшой, так как в то время еще не все функции XII фактора были известны, и авторы не применяли антифибринолитики. В 1972 году Matras и соавторы [546] с успехом применили криопреципитированный концентрированный фибриноген с усилены XII фактором для склеивания нервов в опытах с животными. Позже был открыт апротинин (ингибитор трипсина из поджелудочной железы коров), который значительно расширил возможности управления фибринолизом и дегенерацией фибрина [463]. Теоретическими преимуществами использования фибринового клея для восстановления целостности ахиллова сухожилия являются малая травматичность, анатомическая реконструкция, отсутствие нарушения морфологии сухожилия вдали от места разрыва шовным материалом, исключение ишемии за счет отсутствия шовного материала и более точное сопоставление разорванных концов сухожилия [341, 612, 660]. Положительное влияние фибринового клея на сухожильную ткань было доказано в опытах с животными [212, 215, 357, 505, 634, 687, 750, 749].
Методика склеивания ахиллова сухожилия появилась в начале 80-х годов прошлого века, и, по нашим данным, первая публикация, обобщающая опыт применения фибринового клея, была сделана Paar и соавторами в 1984 году [612]. Позже появились и другие работы [212, 351 и др.], однако широкого распространения этот метод так и не получил.
Redaelli и соавторы установили, что успешное склеивание ахиллова сухожилия возможно в том случае, если оно будет выполнено не позднее одних суток после травмы [660]. Однако Hohendorff и соавторы [379] наблюдали успешное сращение даже в тех случаях, когда склеивание было выполнено спустя семь суток. Опытом успешного склеивания сухожилия на аналогичных сроках также обладают Paar и соавторы [612].
Самая качественная, на наш взгляд, работа, посвященная изучению этой оригинальной методики, была выполнена Hohendorff и соавторами [379]. В их исследование вошел 31 пациент, проходивший лечение в одной из швейцарских больниц с 1987 по 1999 год. Использовался фибриновый клей Tissucol (Baxter International Inc., Deerfield, IL) в объеме 1 мл. По решению хирурга склеенное ахиллово сухожилие армировали сухожилием подошвенной мышцы, которое оборачивали в виде цифры 8 и подшивали к ахиллову сухожилию по методике Sterli [726]. Сравнение результатов выполняли с группой пациентов, которым было выполнено открытое сшивание по Krackow [456]. Средний срок наблюдения составил 12,1 лет (статья была опубликована в 2008 году). В результате оказалось, что долгосрочные результаты в группах по шкале Thermann были одинаковыми, но число осложнений в группе фибринового клея оказалось меньшим. Соответственно, отдаленные результаты показали жизнеспособность этого метода, который может быть достойной альтернативой традиционным хирургическим методам. Но в целом эта методика распространена мало. Возможно, это связано как с некоторым скепсисом хирургов, так и с недоступностью клея.
Консервативное лечение
Консервативное лечение возможно в тех случаях, когда оно начато в течение первых суток после травмы, так как только на ранних сроках удается достичь соприкосновения концов поврежденного сухожилия. В нашей стране консервативный метод лечения использовали С.С.Ткаченко и Л.Е. Лысковец-Чернецкая [117].
Наиболее распространенным способом консервативного лечения свежих разрывов ахиллова сухожилия является иммобилизация в эквинусном положении на 6-8 недель [251]. Сторонники этого метода лечения считают, что он позволяет получить результаты, аналогичные оперативному лечению, исключив при этом свойственные ему осложнения [332, 339, 477, 601, 722, 721]. В большинстве случаев при разрыве ахиллова сухожилия его паратенон остается интактным, однако он неизбежно повреждается в ходе оперативного лечения, что приводит к снижению перфузии сухожилия и его регенераторного потенциала [722]. Следовательно, сохранение паратенона позволит создать благоприятные условия для сращения сухожилия, и именно этот постулат ставится во главу угла сторонниками консервативного лечения. Lea и Smith [477] при исследовании 55 случаев лечения иммобилизацией на 8 недель по поводу спонтанного разрыва ахиллова сухожилия сообщили о реруптуре у 7 (13%) пациентов, при этом только лишь трое из них были неудовлетворены результатом. Совершенно иные выводы были сделаны Persson и Wredmark [624], которые в результате консервативного лечения 20 пациентов зарегистрировали повторный разрыв у семи, и еще семь пациентов были неудовлетворенны результатом, причем не все из неудовлетворенных пациентов перенесли реруптуру. Хотя функциональные результаты после консервативного лечения в целом расцениваются как хорошие, высокая частота реруптур значительно ограничивает применение этого метода. Помимо этого, ключом к успеху при лечении разрывов ахиллова сухожилия является недопущение его сращения с удлинением, то есть его элонгации, и, к сожалению, именно этот недостаток достаточно часто возникает при консервативном лечении [716].
В последнее десятилетие все большее распространение получает функциональный подход к послеоперационному лечению разрывов ахиллова сухожилия, предложенный Carter и соавторами еще в 1992 году [244]. Позже McComis и соавторы [552] консервативно пролечили 15 пациентов с использованием функционального брейса. Ими были получены хорошие функциональные результаты, которые говорят о том, что у определенной группы высокодисциплинированных пациентов функциональные брейсы могут быть вполне жизнеспособной альтернативой оперативному лечению или традиционной жесткой иммобилизации при лечении свежих разрывов ахиллова сухожилия.
У некоторых, особенно пожилых пациентов, не обращавшихся за медицинской помощью после разрыва ахиллова сухожилия, может произойти вполне удовлетворительная функциональная адаптация. В таких случаях целесообразно динамическое наблюдение, и если произойдет ухудшение симптомов, следует прибегнуть к оперативному лечению. Однако у таких самоадаптировавшихся пациентов дополнительное лечение обычно не требуется [513].
История лечения подкожного разрыва ахиллова сухожилия начиналась с консервативных методов. Однако сообщения по этому вопросу были разрозненными и противоречивыми. В связи с высокой частотой осложнений хирургического метода в 60-70-х годах нашего века вновь возник интерес к неоперативному лечению. Начало положили американские хирурги R.B.Lea и L.Smith, которые в 1968 и 1972 годах сообщили о благоприятных результатах иммобилизации конечности в положении «свободно свисающей стопы» в течение 8-ми недель и последующей ходьбе с приподнятой пяткой на каблуке еще в течение 4-х недель [477, 478]. Дальнейшее развитие эта методика получила в Северной Америке, Англии и Скандинавских странах [339, 494, 600, 722]. Некоторые авторы, получив в сравнительном исследовании хирургического и нехирургического лечения примерно равные функциональные результаты, назвали консервативное лечение методом выбора. Измеряя изокинетическую силу трехглавой мышцы, они не получили достоверных различий в обеих группах [339, 395, 601]. Garden D.G. и соавт.(1987) однако показали, что хорошие результаты наблюдались только, если метод применялся в первые 48 часов после травмы, когда организовавшаяся гематома еще не препятствует контакту сухожильных концов [332]. Оценивая результаты динамометрических исследований, следует заметить, что изокинетический режим работы отражает деятельность в основном быстрых фазовых мышечных волокон, которые при отсутствии натяжения страдают мало. Исследования же силы изометрических сокращений, выносливости и мышечной массы обнаружили значительное ухудшение эти показателей [356, 624, 668]. Так, у консервативно леченных пациентов сила мышцы составляла только 62%, а выносливость-64% от нормы, против 88 и 91% соответственно у больных после оперативного лечения [387].
Большинство авторов, использовавших консервативный метод, отмечают, что при удовлетворительной функции конечности часто наблюдается сращение концов сухожилия с удлинением, влекущее за собой ослабление мышцы, а также повышение риска повторных разрывов. Частота повторных разрывов при этом колеблется от 13 до 30% и в среднем составляет 17.7% против 1.5-2% у оперативно леченных больных [324, 425, 455, 694, 796]. Следует обратить внимание, что отечественные специалисты практически единодушно предпочитают оперативное лечение, отводя место консервативному методу лишь при мышечно-сухожильных разрывах в ранние сроки [69, 71, 87, 89, 117].
Подводя итог, необходимо выделить следующее. Как данные патофизиологии мышцы и сухожилия, так и клинический опыт свидетельствует, что консервативный метод лечения подкожного разрыва ахиллова сухожилия предусматривает длительную иммобилизацию мышцы при ослабленном ее натяжении и не препятствует мышечной ретракции, что приводит к ухудшению функции мышечно-сухожильного комплекса. Поэтому применение его допускается только в ранние сроки у неспортсменов и пожилых и лишь потому, что высок риск послеоперационных осложнений [300, 356, 387, 495, 496, 624, 751].
Сравнение оперативного и консервативного лечения свежих разрывов ахиллова сухожилия
Существует достаточно большое количество работ, сравнивающих оперативное и консервативное лечение свежих разрывов ахиллова сухожилие, однако лишь немногие из них [251, 601, 804] представлены контролируемыми, проспективными, рандомизированными исследованиями. Весьма серьезным препятствием для выполнения исследований с корректным с точки зрения доказательной медицины дизайном является отсутствие общепринятых и валидных методологических инструментов оценки объективных и субъективных результатов [484].
Gillies и Chalmers [339] измеряли силу плантарной флексии после оперативного и консервативного лечения свежих разрывов ахиллова сухожилия. Преимущества по этому показателю в группе оперативного лечения были незначительными и, по мнению авторов, не компенсировали риск осложнений как анестезиологического пособия, так и самой операции. Inglis и соавторы [387] произвели сравнение 44 пациентов, составивших группу оперативного лечения, и 23 пациентов, вошедших в группу консервативного лечения. В группе оперативного лечения не было зафиксировано случаев реруптур, но в консервативной группе реруптуры имели место у 9 (39%) пациентов. Помимо этого, функциональные результаты были лучшими после оперативного лечения, в связи с чем авторы адвокатировали именно этот метод лечения. Nistor [601] провел проспективное, рандомизированное исследование 105 пациентов. У 45 применялось оперативное лечение, а у 60 – консервативное. Частота реруптур составила 4% и 8% соответственно, но частота других осложнений в группе оперативного лечения была значительно большей. По таким показателям, как срок нетрудоспособности и контрактура голеностопного сустава результаты были лучше после консервативного лечения, а сила плантарной флексии в группах была равной. Так как функциональные различия были минимальны, Nistor рекомендовал консервативное лечение. В исследование Garden и соавторов [332] вошли 76 пациентов, которых лечили консервативно и 56 пациентов, которых лечили оперативно. В ходе исследования также выполнялось сравнение по срокам начала лечения после получения травмы. Общая частота осложнений в группах составила 4% и 17% соответственно. Субъективные результаты были лучше после консервативного лечения. Помимо этого, авторы пришли к выводу, что при давности разрыва менее 48 часов пациентов следует лечить консервативно (иммобилизацией в эквинусном положении на 8 недель), а свыше этого срока – оперативно.
В рандомизированном исследовании Thermann и соавторы [753] выполнили сравнение 22 случаев оперативного и 28 — консервативного лечения. В обеих группах применялся разработанный авторами функциональный метод иммобилизации специальным ботинком. Функциональные результаты в группах не различались, а применение оригинальной методики позволило сократить период реабилитации.
Kellam и соавторы [423] провели мета-анализ, в который вошли 609 пациентов, получавших оперативное лечение, и 208 – консервативное. Частота реруптур в оперативной группе равнялась 1%, а в консервативной – 18%. 83% пациентов в группе оперативного, и 69% пациентов группы консервативного лечения полностью восстановили прежний функциональный уровень. Субъективна оценка показала, что 93% пациентов оперативной группы и 66% пациентов консервативной группы были удовлетворены результатами лечения.
Cetti и соавторы [251] выполнили проспективное, рандомизированное исследование 56 пациентов, получавших оперативное лечение, и 55 пациентов, получавших консервативное лечение. Частота осложнений и реруптур в группах составила 9% и 5% соответственно в группе оперативного лечения и 16% и 15% соответственно в группе консервативного лечения. Помимо этого авторы выполнили мета-анализ 4597 случаев разрыва ахиллова сухожилия, по результатам которого оперативное лечение позволяло получить меньшую частоту реруптур и других осложнений. В связи с этим Cetti и соавторы методом выбора считали оперативное лечение, а консервативное расценивали как вполне адекватный альтернативный метод.
Lo и соавторы [498] произвели количественный анализ всех исследований, опубликованных на английском языке с 1959 года по 1997 год. Все обнаруженные статьи рассматривались тремя-четырьмя независимыми, которые независимо оценивали методологическую ценность работ. После этого были выбраны валидные работы, которые опять же оценивались независимыми авторами по стандартизованному алгоритму. В тех случаях, когда корректная экстракция данных для сравнения была затруднительна, решение принималось путем голосования. Главными результатами, по которым производилась оценка, являлись сила плантарной флексии, срок нетрудоспособности, восстановление спортивных достижений, частота реруптур и других осложнений, которые были классифицированы на большие, средние и малые. В исследование вошло 742 (оперативное лечение) и 248 пациентов (консервативное лечение). Общая частота реруптур составила 3% и 12% соответственно (p < 0.001). При этом в группе консервативного лечения частота малых и средних осложнений была в 20 раз меньшей).
Таким образом, в настоящее время отсутствует консенсус о наилучшем методе лечения свежих разрывов ахиллова сухожилия. При выборе метода лечения следует учитывать сопутствующие заболевания и индивидуальные особенности пациента: при высоких функциональных запросах следует прибегнуть к оперативному лечению, а при невысоких – допустимо консервативное лечение. Чрескожный шов может использоваться в тех случаях, когда пациент обладает высокими эстетическими требованиями или боится «большой» операции [683].
Доказательная медицина
Для математического представления результатов лечения пациентов с разрывами ахиллова сухожилия наиболее часто используются шкалы Leppilahti [484], The AOFAS hindfoot clinical outcome scores [745], Musculoskeletal Functional Assessment Instrument (MFAI) outcome score, Lindholm, Merkel, Thermann [752], ВАШ и др. Мы приведем только две первые шкалы оценки результатов.
Шкала оценки результатов лечения пациентов с разрывами ахиллова сухожилия (Leppilahti и соавторы, 1998 [484])
В отличие от шкалы Leppilahti шкала оценки результатов пациентов с заболеваниями и травмами стопы и нижней трети голени американского общества хирургии стопы и лодыжек (The American Orthopaedic Foot and Ankle Society ankle-hindfoot score) [745] не выделяет отличные, хорошие, удовлетворительные и неудовлетворительные результаты в зависимости от полученных баллов. Авторы шкалы посчитали такое ранжирование нецелесообразным, поскольку оно не имеет четких критериев а само ранжирование может необоснованно затруднить интерпретацию результатов [444].
Шкала AOFAS [745]
Приведенные шкалы оценки результатов являются, пожалуй, наилучшим инструментом, позволяющим выяснить преимущество той или иной методики лечения пациентов.
Сформировавшееся в последние десятилетия противостояние сторонников консервативного и оперативного лечения обусловлено отсутствием четкого консенсуса: какой метод лечения острого разрыва ахиллова сухожилия является наилучшим? Открытое оперативное лечение чаще применяется у спортсменов и у молодых людей, а чрескожные оперативные методики чаще применяются у людей, которые отказываются от открытого оперативного лечения (например, по эстетическим соображениям не хотят иметь послеоперационный рубец). Консервативное лечение чаще применяется у пожилых пациентов [216, 514, 541, 653].
Первый количественный обзор, посвященный изучению оптимальной тактики лечения свежих разрывов, был выполнен Lo и соавторами в 1997 году [498]. В работу были включены все исследования, опубликованные на английском языке с 1959 and 1997 год. Общая частота реруптур в группах оперативного лечения составила 2,8%, а в группах консервативного лечения – 11,7% (p < 0,001). Частота «малых» осложнений в группах оперативного лечения была в 20 раз большей, чем в группах консервативного лечения. Различия по частоте «крупных» осложнений были незначимы. В заключении авторы делают вывод о том, что лечение должно быть индивидуальным и учитывать потребности и сопутствующие заболевания пациента. При этом Lo и соавторы отметили, что для определения оптимальной тактики оперативного и консервативного лечения необходимы дополнительные исследования, отвечающие требованиям доказательной медицины [498].
Следующий систематический обзор, а именно количественный систематический обзор рандомизированных и квазирандомизированных исследований, сравнивающих консервативное и оперативное лечении, был выполнен Bhandari и соавторами в 2002 году [204]. В качестве основной конечной точки авторы выбрали реруптуру, а в качестве вторичных – глубокие инфекции области хирургического вмешательства, функциональные нарушения и возврат к прежнему уровню физической активности. В обзор были включены исследования, опубликованные с 1969 по 2000. Всего авторы обнаружили 273 работы, из них только 11 были признаны частично и 6 полностью удовлетворяющими требованиям систематического обзора. Авторы пришли к аналогичным выводам о том, что частота реруптур значительно выше при консервативном лечении, но оперативное лечение сопряжено с более высоким риском иных осложнений. Полученные широкие доверительные интервалы снижения риска вынудили авторов заключить о необходимости проведения дополнительных крупных исследований.
Следующим крупным исследованием стал кокрановский обзор Khan и соавторов [435], опубликованный в 2004 году. В связи с особой ценностью кокрановских обзоров, мы остановимся на этой работе более подробно. Авторы суммировали и провели мета-анализ рандомизированных контролируемых исследований эффективности различных способов лечения острых разрывов ахиллова сухожилия.
При проведении своего исследования Khan и соавт. сформулировали и проверили следующие стартовые гипотезы:
1. Нет различия в исходах при оперативном и консервативном лечении.
2. Нет различия в исходах при различных способах консервативного лечения.
3. Нет различия в исходах при различных способах оперативного лечения.
4. Нет различия в исходах при различных способах послеоперационной иммобилизации.
Критерии включения: все рандомизированные исследования, сравнивающие оперативное и консервативное лечение острого разрыва ахиллова сухожилия. Квазирандомизированные исследования (с распределением по альтернации или по возрасту, например) и исследования, в которых имелись статистические дефекты при обработке материала, в основное исследование не включались, но их результаты принимались во внимание.
Критерии пациента: Взрослые с острым разрывом ахиллова сухожилия. В исследование не включались пациенты с реруптурами и с застарелыми разрывами (более трех недель после травмы).
Критерии лечения: оперативное (открытое и чрескожное) и консервативное (иммобилизация лонгетой и функциональный брейс), послеоперационная иммобилизация.
Оценка результатов проводилась по следующим параметрам:
- Осложнения (включая реруптуры, инфекционные осложнения, рубцово-спаечный процесс и повреждения нервов).
- Продолжительность стационарного лечения.
- Срок нетрудоспособности.
- Срок возвращения к занятиям спортом.
- Спортивные возможности после лечения.
- Длина окружности икр.
- Элонгация сухожилия.
- Тест силы.
- Амплитуда движений.
- Боль.
- Удовлетворенность пациента.
Критерии поиска: регистр «Cochrane Musculoskeletal Injuries Group» (до сентября 2003 года), реферативный список литературы, Cochrane Central Register of Controlled Trials in The Cochrane Library, MEDLINE, EMBASE и CINAHL. В исследование были включены все работы, независимо от языка написания.
Исследования обрабатывались методом мета-анализа четырьмя независимыми экспертами доказательной медицины. При оценке исходов привлекались три эксперта. Все исследования при анализе были ослеплены. Не было зарегистрировано конфликтных и спорных ситуаций между экспертами и авторами. При анализе результаты ранжировались на группы A, B или C в соответствии с требованиями доказательной медицины, опубликованными в Cochrane Reviewers’ Handbook [145]. Применялись следующие критерии внутренней и внешней валидности:
1. Метод рандомизации. При отсутствии претензий к распределению (т.н. рандомизация методом запечатанных конвертов) присваивался рейтинг «А» (три балла), при наличии вероятности «выявления» до распределения присваивался рейтинг «В» (два балла), при нечетом механизме рандомизации присваивался рейтинг «В» (один балл) и рейтинг «С» (ноль баллов) присваивался квазирандомизированным исследованиям.
2. При наличии четких критериев включения и исключения — один балл, при отсутствии таковых — ноль баллов.
3. Были ли качественно описаны группы лечения и контроля? Один балл — при наличии как минимум трех параметров (пол, возраст, сторона поражения, время после травмы, механизм разрыва, спортивная активность) и отсутствии значимых статистических различий между группами. В противном случае – ноль баллов.
4. Критерий внутренней валидности: Владели ли хирурги одинаково качественно оперативным и консервативным лечением? Да — один балл, нет — ноль.
5. Критерий внутренней валидности: Были ли идентичны программы лечения? Да — один балл, нет — ноль.
6. Наличие четких критериев оценки результатов лечения. Да — один балл, нет — ноль.
7. Наличие ослепления при оценке результатов. Да — один балл, нет — ноль.
8. Отсутствие изменения состава групп после рандомизации. Да — один балл, нет — ноль.
9. Время оценки результатов (наблюдения) не менее 12 месяцев. Да — один балл, нет — ноль.
10. Потеря наблюдаемого количества пациентов составила менее 5% (за исключением случаев смерти). Да — один балл, нет — ноль.
Для каждого исследования был подсчитан относительный риск и 95% доверительный интервал. Всего было включено 14 работ (891 пациент). 4 исследования (356 пациентов) сравнивали открытое оперативное лечение с консервативным. В 3 исследованиях оперативное лечение осуществлялось по методике шва «конец в конец» и реконструкцией паратенона с последующей иммобилизацией лонгетой (Cetti, 1993; Nistor, 1981) [251, 601] или применением функционального брейса (Moller, 2001) [570, 571] в эквинусном положении на срок 6-9 недель. При консервативном лечении применялась иммобилизация лонгетой на срок 8 недель: 4 недели в эквинусе и 4 недели в нейтральном положении (Cetti, 1993; Moller, 2001) [251, 570, 571] или полу-эквинусе (Nistor 1981) [601]. Schroeder в 1997 году [692] разделил на три группы методом рандомизации 43 пациентов: группа оперативного лечения (13 пациентов), чрескожный шов (15 пациентов) и консервативное лечение (15 пациентов); у всех пациентов применяли иммобилизацию специальным ботинком с трехсантиметровым каблуком на 4 недели с последующим постепенным снижением высоты каблука в течении еще 4 недель. Группа чрескожной фиксации при проведении мета-анализа была исключена.
Шесть исследований оценивали различные способы послеоперационного ведения больных. Пять исследований (273 пациента) сравнивали жесткую иммобилизацию (лонгетой) и полу-мобильную (функциональный брейс). Cetti (1994) сравнил иммобилизацию лонгетой в положении эквинуса в комбинации со стременем (каблуком) (с разрешенной нагрузкой и плантарной флексией) и иммобилизацию на срок 6 недель, полностью исключающую нагрузку [253]. Mortensen (1999) двухнедельную иммобилизацию жестким функциональным брейсом в эквинусе с последующей иммобилизацией в течение 4 недель полужестким брейсом Don-Joy, позволяющим активную дорсифлексию до нейтрального положения, сравнил с иммобилизацией лонгетой (6 недель в эквинусе и 2 недели в нейтральном положении) с последующей нагрузкой [579]. Kangas (2003) выполнил сравнение иммобилизации в нейтральном положении лонгетой, позволяющей выполнять активную плантарную (6 недель) (Рисунок 80) с иммобилизацией в нейтральном положении без активных движений (6 недель). Нагрузка разрешалась спустя три недели после операции [414].
Kerkhoffs (2002) выполнил сравнение функционального брейса и полужесткой лонгеты, иммобилизирующих стопу в течение 6 недель. Нагрузка разрешалась в неодинаковые сроки [431]. Maffulli (2003) выполнил сравнение двухнедельной иммобилизации лонгетой в эквинусе с последующей иммобилизацией лонгетой в нейтральном положении, позволяющей выполнять активную плантарную флексию (4 недели) с лонгетой нефункциональной иммобилизацией лонгетой (2 недели в эквинусе, затем еще 2 недели в слабом эквинусе и еще 2 недели в нейтральном положении). При этом в группе функционального лечения нагрузка разрешалась сразу после операции, а в группе сравнения – через 4 недели после операции [528]. Сравнение различных вариантов иммобилизации (лонгета выше колена или ниже колена) было выполнено только в одном исследовании (Mortensen 1996), включившем в себя 40 пациентов. Высокую лонгету с эквинусным положением стопы пациенты носили в течение 4 недель, а затем им разрешали нагрузку в брейсе (еще 4 недели), укороченная лонгета с эквинусным положением стопы также применялась в течение 4 недель, а затем пациенты переходили на брейс (еще 4 недели) [580].
В двух работах, включивших в себя 94 пациентов, выполнялось сравнение чрескожного и открытого шва. Lim (2001) выполнил сравнение открытого модифицированного шва по Kessler (с добавочными узловыми швами) с модифицированным чрескожным швом по Ma и Griffith (применялись 6 или 8 проколов кожи); в послеоперационном периоде применялась иммобилизация в течение 10-14 недель [492]. Как уже отмечалось, Schroeder (1997) сравнил открытый шов (одинарный или двойной шов по Kessler), чрескожный шов (модификация методики Ma и Griffith) и консервативное лечение. У всех пациентов применялась иммобилизация специальным ботинком с каблуком высотой 3 см в течение 4 недель, а затем высоту каблука постепенно уменьшали в течение еще 4 недель [692]. В соответствии с задачами этой части мета-анализа группа консервативного лечения была исключена, а группа оперативного лечении (13 пациентов) участвовала в двух секциях мета-анализа, таким образом общее число пациентов равнялось 904 (891+13).
Mortensen (1992) сравнил два вида шва у 51 пациента: открытый 2-жильный шов по Mason и непрерывный 6-жильный (CSSS); иммобилизация в обеих группах применялась в течение 7 недель [578].
Результаты:
1. Различия в исходах при оперативном и консервативном лечении.
Четыре исследования (356 пациентов) (Cetti, 1993; Moller, 2001; Nistor, 1981; Schroeder, 1997) [251, 570, 571, 601, 692].
Все эксперты пришли к выводу, что в группе консервативного лечения риск реруптуры составляет 12,6%, а в группе оперативного лечения – 3,5%. К полученным данным нужно относиться осторожно, поскольку имеются различия по способу хирургического лечения и по сроку иммобилизации в исследованиях. Так же достоверно определен более высокий уровень других осложнений в группе оперативного лечения (34.1%) по сравнению с группой консервативного лечения (2.7%). Наиболее часто в группе оперативного лечения встречались: рубцово-спаечный процесс (адгезия) — 19.7%, нарушения чувствительности — (9.8%), инфекционные осложнения — (4.0%) и другие (0.6%). Не было получено статистически значимых различий при анализе сроков стационарного лечения, хотя имеется ожидаемый тренд увеличения при оперативном лечении. Противоречивые данные были получены при анализе сроков нетрудоспособности и сроков возвращения к занятиям спортом. Срок нетрудоспособности зависит, в первую очередь от характера работы (физическая или работа в офисе), однако только в одном исследовании (Moller, 2001) [570, 571] был учтен этот параметр, так что выводы по этому вопросу будут сделаны позже после появления работ соответствующего качества. Неоднозначную оценку получили и при анализе удовлетворенности пациента в трех исследованиях (Cetti, 1993; Nistor, 1981; Schroeder, 1997) [251, 601, 692], что обусловлено отсутствием единых критериев. Этого удалось избежать в исследовании Moller (2001) [570, 571], который использовал визуальную аналоговую шкалу – в группе оперативного лечения качество жизни было выше на сроках 8 недель и 2 года после разрыва. В двух исследованиях имелись данные об отсутствии различия силы плантарной флексии. Анализ результатов амплитуды движений и окружности голени был также разнороден и не позволил провести мета-анализ по этим показателям.
Общим ответом на «старт-гипотезу» можно считать следующее заключение: консервативное лечение сопряжено с риском реруптуры, в три раза превосходящим таковой при оперативном лечении (относительный риск (ОР)- 0.27, 95% доверительный интервал (ДИ) 0.11-0.64), но с гораздо меньшим риском других осложнений, которым подвержен каждый третий пациент, получающий оперативное лечение (ОР=10.60, 95% ДИ 4.82-23.28). Однако, качество жизни пациентов при хирургическом лечении выше.
2. Различные способы послеоперационной иммобилизации: иммобилизация лонгетой и функциональный брейс.
Шесть исследований (273 пациента) (Cetti, 1994; Kangas, 2003; Kerkhoffs, 2002; Maffulli, 2003; Mortensen, 1999) [253, 414, 431, 528, 579].
Как уже отмечалось, характер исследований был вариабельным: использовались различные типы функционального брейса с различной амплитудой движений и продолжительностью периода исключения нагрузки. В пяти исследованиях был проведен анализ частоты реруптур, статистически значимых различий не получено (5.0% в группе иммобилизации лонгетой и 2.3% в группе функционального брейса (p =0.26)). Значимое несоответствие было получено при анализе частоты других осложнений, особенно рубцово-спаечного процесса. Вероятно, это связано с различной степенью строгости при анализе осложнений во включенных исследованиях: так частота составила 35.7% в группе иммобилизации лонгетой и 19.5% в группе функционального брейса (p = 0.001). Самыми частыми осложнениями в группе иммобилизацией лонгетой являлись: рубцово-спаечный процесс (18.6%), нарушение иннервации (8.6%), келоидный или гипертрофический рубец (5.0%) и другие (3.5%), в группе функционального брейса: рубцово-спаечный процесс (9.7%), нарушение иннервации (3.8%), келоидные рубцы (3.0%) и другие (3.0%).
В одном исследовании имелся достоверный вывод о более низкой продолжительности стационарного лечения в группе функционального брейса (Kerkhoffs 2002) [431]. Maffulli (2003) выяснил, что пациенты в группе функционального брейса раньше отказывались от костылей, меньше обращались за амбулаторной медицинской помощью и раньше прекращали лечение у реабилитолога, однако этот вывод нельзя трансполировать [528]. Также пациенты из группы функционального брейса раньше возвращались к занятиям спортом (Kerkhoffs, 2002; Maffulli, 2003; Mortensen, 1999) [431, 528, 579], однако данные о соответствии физической активности уровню до травмы разноречивы (Cetti, 1994; Mortensen, 1999) [253, 579]. Только в одном исследовании было обнаружено, что пациенты группы функционального брейса больше удовлетворены (Maffulli, 2003) [528], а в других таких различий не обнаружено (Kangas, 2003; Cetti, 1994; Kerkhoffs, 2002) [253, 414, 431]. Однако, Cetti (1994) отметил, что в группе иммобилизации лонгетой больше пациентов жалуются на боль [253].
Cetti (1994) сообщил о более низкой амплитуде движений, повышенной атрофии икроножных мышц и сниженной силе плантарной флексии спустя год после травмы у пациентов группы иммобилизацией лонгетой [253]. Kangas (2003) делает вывод о сниженной функции икроножных мышц в группе пациентов иммобилизацией лонгетой спустя 60 недель после травмы [414]. Эти выводы не поддерживает Mortensen (1999) [579] и Maffulli (2003) [528] которые не обнаружили статистически значимых различий на этапе отдаленных наблюдений. Увеличение диастаза между концами сухожилия чаще встречалось в группе иммобилизацией лонгетой (Cetti, 1994) [253], однако прямо противоположный вывод делает Mortensen (1999) [579]. Нет связи между увеличением диастаза и амплитудой движений. Всесторонняя оценка локомоторной функции была сделана Kangas (2003): единственным отличием между вариантами иммобилизации являлась лучшая координация в группе иммобилизации лонгетой на сроке 12 недель после травмы, а к 24 неделям различие исчезало [414].
Суммируя результаты, можно сделать вывод о том, что применение функционального брейса позволяет сократить срок стационарного лечения, срок нетрудоспособности, и позволяет пациенту быстрее вернуться к занятиям спортом. Так же достоинствами функционального брейса является тренд более низкого процента осложнений (кроме реруптур, ОР 1.88; 95% ДИ 1.27-2.76).
3. Послеоперационная иммобилизация: лонгета выше или ниже колена?
Нельзя сделать достоверный вывод ввиду малой выборки — 40 пациентов (Mortensen, 1996) [580].
4. Открытое хирургическое лечение и чрескожный шов.
Два исследования (94 пациента) (Lim, 2001; Schroeder, 1997) [492, 692].
Нет достоверных различий в частоте реруптур, однако риск инфекционных осложнений выше при открытом хирургическом лечении. Необходимо отметить, что частота инфекционных осложнений в группе открытого хирургического лечения (19,6%) значительно выше, чем в исследованиях, сравнивающих оперативное и консервативное лечение (4.0%). Эту вариабельность трудно объяснить какими-либо причинами. Из-за малого количества пациентов и нестандартизированных методик оценки нельзя сравнивать различия по силы, амплитуде движений и спортивной активности.
Суммируя результаты, можно с уверенностью говорить только лишь о более коротком времени оперативного вмешательства и более низком риске инфекционных осложнений (ОР 10,52, 95% ДИ 1,37-80,52) при чрескожном шве. К этим результатам нужно относиться с некоторой критичностью ввиду малых размеров выборки.
5. Открытое оперативное лечение: двух- или шести-жильный шов?
Сравнение было выполнено только в одном исследовании (51 пациент) (Mortensen, 1992) [578]. В проспективном рандомизированном исследовании было доказано отсутствие преимущества экстенсивного 6-жильного шва над более простым 2-жильным швом (анализировалась частота и выраженность расхождения сшитых концов сухожилия на этапах после операции).
6. Консервативное лечение: лонгета или функциональный брейс?
Два исследования (90 пациентов) (Petersen, 2002; Saleh, 1992) [626, 677]. Нельзя делать достоверные выводы из-за малого количества пациентов, различий в методиках и неполного описания исходов.
На основе полученных в мета-анализе данных, авторы сформулировали следующие рекомендации:
Практические рекомендации. Рандомизированные исследования показали, что оперативное лечение по поводу свежих разрывов ахиллова сухожилия позволяет значительно снизить риск реруптуры по сравнению с консервативным лечением. Однако, оперативное лечение сопряжено с гораздо более высоким риском иных осложнений, включаю поверхностные инфекции области хирургического вмешательства. Этих осложнений можно избежать при чрескожном шве, однако число включенных в сравнительные исследования пациентов невелико. Послеоперационная иммобилизация функциональным брейсом по сравнению с иммобилизацией лонгетой приводит к сокращению сроков стационарного лечения, сроков нетрудоспособности и ускоряет возврат пациента к занятиям спортом. Кроме того, функциональный брейс вероятно снижает и общую частоту осложнений.
Отсутствуют адекватные данные, позволяющие сравнить эффективность различных видов сухожильных швов, вариантов послеоперационной иммобилизации и реабилитации.
Научные рекомендации. Для определения «идеального» способа как оперативного, так и консервативного лечения необходимо проводить новые проспективные рандомизированные исследования с большим числом пациентов. При этом необходим полноценный и единый анализ исходов, а сами исследователи должны быть «слепыми». Аналогичные когорты пациентов в будущих исследованиях должны иметь высокую «прозрачность», что позволит получить качественные данные для интерпретации в мета-анализе. Авторам исследований строго рекомендуется публиковать свои результаты только один раз [435].
В 2005 году вышел еще один мета-анализ рандомизированных контролируемых исследований Khan и соавторов, в который вошло 12 исследований (800 пациентов). Были уточнены риски осложнений при оперативном лечении, представленными инфекционными осложнениями, рубцово-спаечными адгезиями сухожилия и расстройствами чувствительности кожи (относительный риск 10.60; 95% доверительный интервал 4.82-23.28). Была подтверждена более низкая частота осложнений при чрескожном шве по сравнению с открытым швом (относительный риск 2.84; 95% доверительный интервал 1.06-7.62), а послеоперационное лечение функциональным брейсом (позволяющим раннюю мобилизацию) также сопровождалось меньшей частотой осложнений по сравнению с иммобилизацией лонгетой (относительный риск 1.88; 95% доверительный интервал 1.27-2.76) [436].
Чрезвычайно интересна беспристрастность иностранных коллег к научным исследованиям. Например, Dobson MH и Nguyen C. [294] после публикации в Journal of Bone and Joint Surgery мета-анализа Khan и соавторов [436] написали в редакцию журнала письмо, в котором просили уточнить авторов мета-анализа некоторые детали. На самом деле четыре исследования [431, 492, 528, 601], включенные в мета-анализ, не являлись истинно рандомизированными и имели оценку в 0 баллов по параметру рандомизации. В частности исследование Maffulli и соавторов [528] было квазирандомизированным (вариант лечения определялся датой поступления). Подобные неточности могли исказить результаты мета-анализа. Khan и соавторы признали [294], что таковое имело место, однако решение расширить критерии включения было вынужденным, поскольку в целом число проспективных истинно рандомизированных работ, сравнивающих консервативное и оперативное лечение невелико, а данные о рандомизации этих четырех исследований имелись в приложении.
С момента выхода мета-анализа Khan и соавторов [436] до сентября 2009 года были опубликованы результаты еще девяти проспективных рандомизированных исследований, которые пока еще не вошли ни в один систематический обзор. В целом эти работы прекрасно иллюстрируют современные тенденции в лечении пациентов со свежими разрывами ахиллова сухожилия.
Costa и соавторы [268] провели два независимых многоцентровых рандомизированных контролируемых исследования, в которых изучали эффективность немедленной нагрузочной мобилизации после разрыва ахиллова сухожилия в сравнении с традиционной иммобилизацией лонгетой. В одном исследовании пациентов лечили консервативно, а в другом – оперативно. В оба исследования были включены пациенты с давностью разрыва, не превышающим семь суток. В группах немедленной нагрузочной иммобилизации подразумевалось использование брейса, ограничивающего дорсифлексию регулируемой высотой каблука (4,5, 3,0 и 1,5 см). Сразу после начала лечения пациентам разрешали полную осевую нагрузку. В группе оперативного лечения иммобилизацию выполняли в течение 8 недель, постепенно уменьшая высоту каблука брейса. В группе консервативного лечения высоту каблука снижали через шесть недель после начала лечения, а общий срок иммобилизации составлял 12 недель. В группах традиционной иммобилизации использовалась укороченная лонгета (ниже колена), причем при консервативном лечении ее заменяли, постепенно уменьшая степень эквинуса. В результате авторы выяснили, что немедленная нагрузочная мобилизация после оперативного лечения достоверно раньше приводит к нормализации походки и к нормализации подъема по лестнице (5,5 и 9,0 недель соответственно). При этом мобилизация не имела достоверных преимуществ по срокам нетрудоспособности, срокам возврата к занятиям спортом и по качеству жизни (EuroQol health status). Однако, у двух пациентов в группе нагрузочной мобилизации произошли реруптуры на этапах лечения, что выдвигает повышенные требования к отбору пациентов для функционального лечения, так как недисциплинированные пациенты склонны нарушать рекомендации и необоснованно расширять разрешенные нагрузки. При консервативном лечении ни по одной из конечных точек различий между двумя вариантами иммобилизации получено не было. В целом можно отметить, что при адекватном отборе пациентов немедленная нагрузочная мобилизация не сопровождается повышением частоты осложнений (реруптур, сращений с удлинением), что позволяет сделать вывод о предпочтительности такого варианта как при консервативном, так и при оперативном лечении. Данные Costa и соавторов [268] являются логичным продолжением идеи функционального подхода. Например, A.A. Suchak и соавторы [730] провели мета-анализ исследований, изучавших различные варианты послеоперационной иммобилизации. Традиционной иммобилизации лонгетой в эквинусном положении на смену постепенно приходят функциональные подходы. По результатам этого мета-анализа, включившего в себя шесть рандомизированных и квазирандомизированных исследований (315 пациентов) было обнаружено, что функциональная иммобилизация не сопровождается повышением частоты реруптур, но повышает качество жизни пациентов.
Kangas и соавторы [413] провели проспективное рандомизированное исследование двух вариантов послеоперационной иммобилизации (50 пациентов со свежими разрывами ахиллова сухожилия). Функциональная иммобилизация (брейс, разрешающий движения стопой в амплитуде межу нейтральным положением и эквинусом, в течение 6 недель) сравнивалась с иммобилизацией лонгетой в нейтральном положении (6 недель). В обеих группах полную осевую нагрузку разрешали через три недели после операции. В ходе операции в проксимальную и дистальную культи сухожилия вставляли рентгенконтрастные метки, по которым после операции судили о элонгации сухожилия. В результате было обнаружено, что элонгация при функциональной иммобилизации была даже меньше, чем при полной иммобилизации (2 мм и 5 мм соответственно через 60 недель после операции, p=0,054), и не коррелировала с возрастом, полом и индексом массы тела пациентов. При этом имелась достоверная корреляция (обратная зависимость) элонгации и функциональных результатов по шкале Leppilahti [484].
B.C. Twaddle и соавторы [770] также провели сравнение консервативного и оперативного лечения свежих разрывов ахиллова сухожилия, при этом в обеих группах использовалась функциональная иммобилизация (ограниченные движения в съемном брейсе разрешались сразу после начала лечения). В результате не было обнаружено достоверных различий между группами по показателям амплитуды движений, длине окружности голени в верхней трети и результатам по шкале MFAI.
A. Gigante и соавторы [337] провели проспективное рандомизированное исследование, сравнивающее открытый и чрескожный шов системой Tenolig при свежих разрывах ахиллова сухожилия (40 пациентов). Программа послеоперационного лечения в группах не отличалась. Было выяснено, что достоверных отличий по результатам между группами не было, за исключением длины окружности голени, которая была большей после чрескожного шва. Учитывая меньшую частоту осложнений при чрескожном шве авторы склонны пропагандировать чрескожный шов, однако, мы считаем, что финансовое лоббирование производителей систем для чрескожных швов должно настораживать клиницистов в чрезмерно оптимистичной оценке таких новых методов лечения.
R. Metz и соавторы [562] при сравнении консервативного лечения методом функционального брейса и чрескожного шва (в обеих группах применялась немедленная нагрузочная мобилизация) пришли к выводу, что статистически значимых различий по показателям частоты осложнений, боли, удовлетворенности от лечения и срокам возврата к занятиям спортом не было, а по срокам нетрудоспособности имелись достоверные преимущества в группе чрескожного шва (59 суток по сравнению с 108 сутками при консервативном лечении, p<0,05).
Еще одна работа, посвященная изучению ранней нагрузочной мобилизации, принадлежит перу A.A. Suchak и соавторов [729], которые сравнили различные варианты послеоперационного лечения у 110 пациентов. Все пациенты после открытого шва ахиллова сухожилия не опирались на конечность в течение 2 недель, а затем они были рандомизированы в две группы: в одной использовался функциональный брейс, а в другой – ненагрузочная иммобилизация. Общий срок иммобилизации составлял 6 недель. Общий срок иммобилизации составлял 6 недель. Через шесть недель после операции имелись значительные преимущества по шкале качества жизни RAND-36 (36-Item Health Survey) в группе нагрузочной иммобилизации по функциональным, социальным, эмоционально-ролевым и жизнеспособным разделам (p < 0.05). Также через 6 недель пациенты группы нагрузочной мобилизации отметили значительно меньшее ограничение своей повседневной активности (p < 0.001). Через шесть месяцев достоверных отличий между группами не было.
Aktas и соавторы [141] сравнили результаты лечения пациентов при использовании открытого шва по Krakow и чрескожного шва по методике Achillon. Функциональные результаты по шкале AOFAS равнялись 96,8 и 98,7 баллам (p>0,05). Несмотря на отсутствие статистически значимых различий авторы отдали предпочтение методике чрескожного шва, поскольку она является малоинвазивной с вероятно меньшим риском осложнений.
В оставшихся двух рандомизированных проспективных исследованиях авторы изучали первичное армирование при свежих разрывах ахиллова сухожилия. Ari Pajala и соавторы [615] рандомизировали 60 пациентов со свежими разрывами в две группы. В первой группе выполнялось сшивание сухожилия по Krackow, а во второй группе шов дополнялся пластикой по Silfverskiöld [705]. В результате авторы обнаружили, что первичное армирование достоверно удлиняло время операции в среднем на 25 минут, увеличивало протяженность разреза на 7 см (p < 0.001 для обоих показателей), при этом преимуществ по частоте реруптур и функциональным результатам не было [615].
Aktas и соавторы [142] проанализировали функциональные и клинические результаты пациентов при сшивании ахиллова сухожилия по Krackow с первичным армированием сухожилием m. plantaris и без такового. Через 17,8 месяцев результаты по шкале AOFAS составили 96,7 баллов при первичном армировании и 98,8 баллов при простом шве по Krackow (p>0,05). Так как первичное армирование утяжеляет операцию, то его не слеует выполнять при свежих разрывах ахиллова сухожилия с устранимым диастазом.
Ретроспективные исследования с точки зрения доказательной медицины имеют гораздо меньшую ценность, чем проспективные, однако одна из таких работ на наш взгляд представляет интерес. Ebinesan и соавторы сделали упор на экономические показатели при открытом шве, чрескожном шве и консервативном лечении разрывов ахиллова сухожилия. При консервативном лечении были обнаружены достоверно большие значения по показателям частоты смены иммобилизирующих устройств (p<0,001), средней продолжительности иммобилизации (p<0,001) и числу амбулаторных явок пациентов (p<0,05). При этом консервативное лечение было наименее финансово затратным, а открытый шов – наиболее дорогим. Чрескожный шов при условии выполнения под местной анестезией обходился примерно втрое дешевле, чем открытый шов [299]. Таким образом, по экономическим соображениям чрескожный шов и консервативное лечение представляются серьезными конкурентами открытому оперативному лечение, которое к тому же сопровождается значительно большим числом осложнений, но выбор метода лечения в первую очередь должен учитывать функциональные запросы.
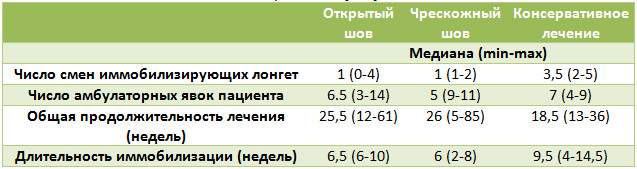
Лечение несвежих разрывов ахиллова сухожилия
К несвежим разрывам Mafulli [514] относит те разрывы, после возникновения которых прошло более 72 часов. Если прооперировать пациентов ранее этого срока, то практически никогда не возникает трудностей с устранением диастаза разорванных концов сухожилия и сшиванием их по типу конец-в-конец [517]. Однако, примерно в 20% случаев в силу различных обстоятельств диагноз не распознается своевременно [511]. При операциях на сроках позже 72 часов после травмы освежевание и ретракция трехглавой мышцы голени приводят к тому, что диастаз может быть устранен только со значительным натяжением, что требует применения пластических маневров. Наиболее часто используются низводящие лоскуты (один центральный по Чернавскому [129], по Boswoth [217], боковой по Silfverskiöld [705], по Г.Д. Никитину [86] или латеральный и медиальный по Lindholm [494]). Если имеется сухожилие m. plantaris, то оно также может использоваться в качестве армирующего шовного пластического материала [507]. Подробнее пластические операции будут описаны в главе 6.
В тех случаях, когда концы сухожилия значительно дегенеративно изменены, что делает невозможным сопоставление культей, применяют пластику сухожилиями mm. tibialis posterior и peroneus brevis, которые могут быть рассечены вдоль и использованы как несвободные лоскуты на ножке, а могут использоваться целиком в дополнение к низведенным лоскутам [317]. Wapner и соавторы [782, 783] транспонировали сухожилие flexor hallucis longus, выполняя динамическую реконструкцию. Эта методика была применена у 7 пациентов (средний возраст 52 года). В среднем через 17 месяцев (3-30 месяцев) не было зарегистрировано каких-либо осложнений, за исключением функционально незначимого ограничения амплитуды движений в голеностопном суставе и в суставах первого пальца стопы [783].
В тех случаях, когда диастаз настолько велик, что его невозможно устранить с помощью описанных методик, можно выполнить протезирование сухожилия с использованием полимеров Dexon (полигликолевая кислота) или сетки Marlex (связанные монофиламентные полипропиленовые нити) [382, 610], которые необходимо укрыть сухожилиями. Послеоперационный период у таких пациентов должен быть значительно более жестким, с пролонгированным (8 недель вместо 6) ограничением нагрузки и амплитуды движений.
Резюме
Этиология и патогенез такого, казалось бы простого состояния, как разрыв ахиллова сухожилия, при более детальном знакомстве с проблемой оказываются не столь просты и однозначны. Более того, несмотря на пристальный интерес большого числа хирургов и многочисленные исследования, получены четкие ответы лишь на малую часть вопросов. Исследования на животных позволяют получить не совсем корректную информацию, так как, во-первых, само ахиллово сухожилие человека уникально, и, во-вторых, у животных повреждение сухожилия моделируется тенотомией, что далеко не идентично истинному разрыву [203, 402, 585]. А биомеханические модели [181, 182, 183] навряд ли близки к истинным условиям нагрузок, испытываемых ахилловым сухожилием, так что практическая ценность полученных знаний невелика.
Выбор метода лечения острых разрывов ахиллова сухожилия в большинстве случаев определяется личными предпочтениями хирурга. Открытое оперативное лечение позволяет получить в целом более высокие функциональные результаты, но сопряжено с более высокой частотой осложнений. Главными недостатками консервативного лечения являются высокая частота реруптур и менее высокие функциональные результаты, но при этом исключаются осложнения оперативного лечения.
Одну из главных методологических проблем представляет собой отсутствие универсальной валидной шкалы оценки результатов лечения разрывов ахиллова сухожилия. Наилучшая шкала предложена Leppilahti и соавторами [484, 487], которая включает в себя субъективную оценку и изокинетическое измерение силы плантарной флексии. Однако, этот инструмент используется другими авторами редко, что объясняется достаточно высокой стоимостью и малой распространенностью установок изокинетической динамометрии.
Если предположить, что эпидемиологические данные действительно соответствуют истинному повышению частоты разрывов ахиллова сухожилия в последние десятилетия, то изучение вопросов лечения этой патологии представляет собой одну из самых актуальных задач ортопедии.
Перспективными направлениями являются разработка методов стимуляции сращения [765], что станет возможным благодаря более пристальному изучению биохимических процессов, например влияния цитокинов [254], или использования достижений тканевой и генной инженерии [336]. Однако такие новаторские решения навряд ли будут возможны в широкой клинической практике в ближайшей перспективе.
Cтатья предназначена исключительно для всестороннего информирования о заболевании и о тактике его лечения. Помните, что самолечение может навредить Вашему здоровью. Обратитесь к врачу.

